
| A. | 水玻璃 | B. | 太阳能电池 | C. | 黏土 | D. | 普通水泥 |
分析 硅酸盐指的是硅、氧与其它化学元素(主要是铝、铁、钙、镁、钾、钠等)结合而成的化合物的总称,陶瓷、玻璃、水泥等都是硅酸盐产品,太阳能电池板的成分是单志硅,属于非金属单质,不属于硅酸盐,据此分析解答.
解答 解:A.水玻璃是硅酸钠的水溶液,含有硅酸盐,其溶液具有粘性,是一种矿物胶,其不燃烧也不易受腐蚀,属于硅酸盐,故A不选;
B.太阳能电池板的成分为单质硅,属于非金属单质,不属于硅酸盐,故B选;
C.粘土主要成分为硅酸盐,故C不选;
D.普通水泥是硅酸盐产品,含硅酸盐,故D不选;
故选B.
点评 本题考查硅酸盐的概念和内涵,注意:硅酸盐必须含有硅元素且属于盐类,陶瓷、玻璃、水泥等都是硅酸盐产品是解答的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 观察加热时能否放出气体 | |
| B. | 观察加盐酸时能否放出气体 | |
| C. | 溶于水中,加入澄清石灰水,观察是否有白色沉淀生成 | |
| D. | 溶于水中,滴加少量BaCl2溶液,观察是否有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 1mol该有机物最多可以和4mol Na反应 | |
| B. | 该有机物容易发生加成、取代、中和、消去等反应 | |
| C. | 该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色 | |
| D. | 1mol该有机物与浓溴水反应,最多消耗3mol Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
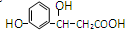 ,它不可以发生的反应类型有:①加成;②水解;③消去;④酯化;⑤银镜;⑥氧化;⑦取代;⑧加聚;⑨缩聚.( )
,它不可以发生的反应类型有:①加成;②水解;③消去;④酯化;⑤银镜;⑥氧化;⑦取代;⑧加聚;⑨缩聚.( )| A. | ①⑤⑧ | B. | ①②⑤⑨ | C. | ②⑥⑧⑨ | D. | ②⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中加入BaCl2溶液,产生不溶于稀盐酸的白色沉淀,则该溶液一定含有SO42- | |
| B. | FeCl3稀溶液与Fe(OH)3胶体本质区别是分散质粒子的大小 | |
| C. | Fe(OH)3胶体可以产生电泳现象,由此可知Fe(OH)3胶体溶液带电 | |
| D. | 用溶解、过滤的方法分离KNO3和NaCl固体的混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com