
某溶液可能含有Cl-、SO42-、CO32-、OH-、NH4+、Al3+ 、Fe3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到 1.6g固体;向上述滤液中加足量BaCl2溶液,得到 6.99g不溶于盐酸的沉淀。
下列关于原溶液的说法正确的是
A.原溶液中至少存在3种离子
B.原溶液中一定不存在的离子是:Cl-、CO32-、OH-
C.原溶液中可能存在的离子有:Cl-、Al3+和K+
D.原溶液中一定存在的离子是:NH4+、Fe3+、SO42-和Cl-,且c(Cl-)≥0.2mol/L
科目:高中化学 来源: 题型:
下列实验结论不正确的是
| 实验操作 | 现象 | 结论 | |
| A | 食醋浸泡水垢 | 产生无色气体 | 乙酸的酸性比碳酸强 |
| B | 乙醇与橙色酸性重铬酸钾溶液混合 | 橙色溶液变为绿色 | 乙醇具有还原性 |
| C | 碘酒滴到土豆片上 | 土豆片变蓝 | 淀粉遇碘元素变蓝 |
| D | 新制Cu(OH)2与葡萄糖溶液混合加热 | 产生红色沉淀 | 葡萄糖具有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列物质的转化关系中,A是一种固体单质,且常作半导体材料,E是一种白色沉淀,F是最轻的气体单质。
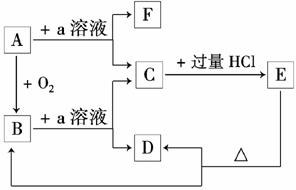
据此填写:
(1)B的化学式是________,目前在现代通讯方面B已被用作________的主要原料。
(2)B和a溶液反应的离子方程式是_________________________________
________________________________________________________________________。
(3)A和a溶液反应的离子方程式是_________________________________________
________________________________________________________________________。
(4)C和过量盐酸反应的离子方程式是__________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿佛加德罗常数的数值,下列说法正确的是
A.1L0.1mol•L-1 Na2CO3溶液中有NA个CO32-
B.常温常压下,22gCO2中共有2NA个共用电子对
C.0.1mol Na2O2与水完全反应,转移的电子数为0.2NA
D.2.8gN2、CO和C2H4组成的混合气体所占有的体积约为2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氧化性Fe3+>I2。向Fe I 2溶液中通入一定量的Cl2,发生反应的离子方程式为:
a Fe2++b I-+c Cl2→d Fe3++ e I2+ f Cl- 。下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
A.2,4,3,2,2,6 B. 0,2,1,0,1,2
C.2,0,1,2,0,2 D. 2,8,5,2,4,10
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D均为中学化学中常见的物质,它们之间的转化关系如下图(部分产物已略去):
试回答:
(1)若D是具有氧化性的单质,则属于短周期的主族金属元素A为 (填元素符号)。
(2)若D是金属单质,D在潮湿的空气中易发生吸氧腐蚀,C溶液在保存时应加入酸和少量D防止其变质,若不加D则C溶液在空气中变质的离子方程式为 ;
将D的氯化物的水溶液蒸干并灼烧产物是 。
(3)若A、B、C均为无机化合物,且均含地壳中含量最高的金属元素E,在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子方程式 。
(4)将第(1)题推出的A单质与第(3)题E单质的混合物11.9g投入一定量的水中充分反应,A与E均没有剩余,共收集到标准状况下的气体vL。向所得溶液中逐滴加入浓度为2mol•L-1的H2SO4溶液,至100mL时白色沉淀达到最大量。则v= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用洗净的废铜屑作原料来制备硝酸铜。为了节约原料和防止污染环境,宜采取的方法是( )
A.Cu+HNO3(浓)―→Cu(NO3)2
B.Cu CuO
CuO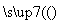 Cu(NO3)2
Cu(NO3)2
C.Cu+HNO3(稀)―→Cu(NO3)2
D.Cu CuSO4
CuSO4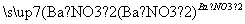 Cu(NO3)2
Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
今有原子序数依次增大的A、B、C、D、E、F六种元素。已知A、C、F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间,两两皆能反应且均能生成盐和水。D和E各有如下表的电子层结构。在一般情况下,B元素不能与A、C、D、E元素的游离态化合而生成B的化合态。
| 元素 | 最外层电子数 | 次外层电子数 |
| D | X | X+4 |
| E | X+1 | X+4 |
按要求填空:
(1)各元素的元素符号分别为C________,E________,D和E两者的氢化物稳定性较强的是________(填化学式)。
(2)工业上制取单质D的化学方程式为_____________________________________。
(3)A与C两元素的最高价氧化物对应的水化物反应的离子方程式为________________________________________________________________________。
(4)A和F形成的晶体中含有的化学键是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com