
| A. | 常温下,23g NO2和N2O4的混合气体含有NA个氧原子 | |
| B. | 1L0.1mol•L-1的氨水含有0.1NA个OH- | |
| C. | 标准状况下,NO和O2各11.2L混合,所得混合气体的分子总数为0.75NA | |
| D. | 1molFe与1molCl2充分反应,转移3NA个电子 |
分析 A、NO2和N2O4的最简式均为NO2;
B、NH3•H2O为弱碱,在溶液中不能完全电离;
C、一氧化氮和氧气反应生成二氧化氮,二氧化氮能转化为四氧化二氮.
D、1molFe与1molCl2充分反应时铁过量,根据氯气的化合价的变化来分析转移电子的个数.
解答 解:A、NO2和N2O4的最简式均为NO2,故23g混合物中含有的NO2的物质的量为n=$\frac{23g}{46g/mol}$=0.5mol,则含有1mol氧原子即NA个,故A正确;
B、NH3•H2O为弱碱,在溶液中不能完全电离,故溶液中的氢氧根的个数小于0.1NA个,故B错误;
C、标况下,一氧化氮和氧气反应生成二氧化氮,二氧化氮能自身转化为四氧化二氮导致混合气体的分子总数小于0.75NA,故C错误;
D、1molFe与1molCl2充分反应时,铁过量,1mol氯气完全反应,由于氯元素由0价变为-1价,故1mol氯气转移2mol电子即2NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NaNO2既具有氧化性又具有还原性 | |
| B. | 1 mol NaNO2在酸性条件下完全反应生成NO和NO2,转移电子的物质的量为1 mol | |
| C. | NaNO2和胃酸作用的离子方程式为:2NO${\;}_{2}^{-}$+2H+=NO↑+NO2↑+H2O | |
| D. | 食用“醋溜豆芽”可能会减少亚硝酸钠对人体的危害 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
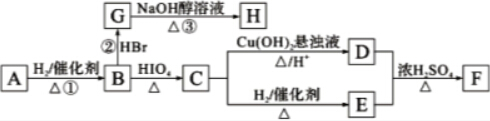
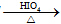 RCHO+R′CHO
RCHO+R′CHO .
. CH3COO-+NH4++2Ag↓+3NH3+H2O.
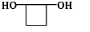
CH3COO-+NH4++2Ag↓+3NH3+H2O. .若H分子中所有碳原子均在一条直线上,则G转化为H的化学方程式为
.若H分子中所有碳原子均在一条直线上,则G转化为H的化学方程式为 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ |
 ,最高价氧化物对应的水化物中,酸性最强的是HClO4(用化学式表示).
,最高价氧化物对应的水化物中,酸性最强的是HClO4(用化学式表示). ,
,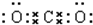 .
. 该化合物属于离子(填“共价”或“离子”)化合物.
该化合物属于离子(填“共价”或“离子”)化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
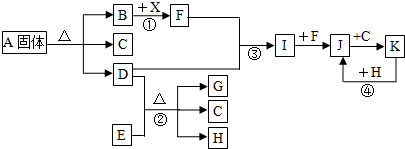
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
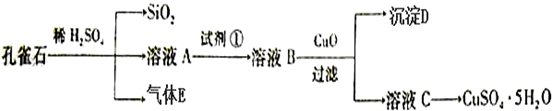
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
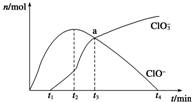 工业上把Cl2通入NaOH溶液中制得漂白液(主要成分NaClO).一化学小组模拟实验得到ClO-、ClO${\;}_{3}^{-}$等离子其物质的量(mol)与反应时间t(min)的关系曲线:
工业上把Cl2通入NaOH溶液中制得漂白液(主要成分NaClO).一化学小组模拟实验得到ClO-、ClO${\;}_{3}^{-}$等离子其物质的量(mol)与反应时间t(min)的关系曲线:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同质量的N2和CO2 | B. | 同质量的H2和N2 | ||
| C. | 同体积的O2和N2 | D. | 相同物质的量的N2O和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水润湿的pH试纸来测量溶液的pH | |
| B. | 实验需要480mL 2.0mol•L-1的氢氧化钠溶液.配制该溶液时先称量氢氧化钠固体38.4g,然后再按照溶解、冷却、移液、洗涤、定容、摇匀的步骤进行操作 | |
| C. | 向溶液中滴加硝酸酸化的Ba(NO3)2溶液出现白色沉淀,说明溶液中一定有SO42- | |
| D. | 用溴水,淀粉、KI溶液比较Br2与I2的氧化性强弱,所需玻璃仪器主要有:试管、胶头滴管 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com