
【题目】如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O,下列说法正确的是
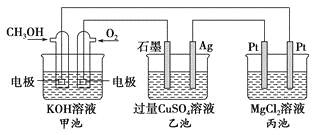
A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO32-+8H+
C. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度
D. 甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45 g固体
【答案】D
【解析】
丙池两端的电极材料相同,应作电解池;甲池是燃料电池,CH3OH中碳元素失电子,化合价升高,作负极,电极反应为CH3OH-6e-+8OH-===CO32-+6H2O;O2得电子,化合价降低,作正极,电极反应为O2+4e﹣+2H2O=4OH-。乙池石墨电极与正极相连,作阳极;Ag电极是阴极。丙池右侧Pt与负极相连,作阴极;左侧Pt是阳极。据以上分析解答。
A项,甲池是燃料电池,属于原电池,是将化学能转化为电能的装置,乙、丙池属于电解池,是将电能转化为化学能的装置,故A项错误;
B项,甲池是燃料电池,CH3OH燃料通入的极是电池的负极,发生氧化反应,因电解质是氢氧化钾,所以电极反应不会生成氢离子,故B项错误;
C项,电解硫酸铜时,阳极放氧气,阴极析出金属铜,所以要让电解质在电解后复原,应加入氧化铜,故C项错误;
D项,丙池中,电解硝酸银时,阴极析出金属银,甲池中的正极发生的电极反应为:O2+4e﹣+2H2O=4OH-,消耗280mL(标准状况下)即0.0125molO2,转移的电子为0.05mol,阴极氢离子得电子生成氢气,致使氢氧根与镁离子结合生成氢氧化镁,则丙池生成氢氧化镁的质量为58g/mol×0.025mol=1.45g,故D项正确;
综上所述,本题选D。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是( )
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 某气体能使品红溶液褪色,则该气体是SO2
B. 等质量的铜按a,b两种途径完全转化为硝酸铜,途径a,b消耗的硝酸一样多:途径a:Cu![]() CuO
CuO![]() Cu(NO3)2;途径b:Cu
Cu(NO3)2;途径b:Cu![]() Cu(NO3)2
Cu(NO3)2
C. 用分别蘸有浓氨水和浓盐酸的玻璃棒相互靠近会产生白烟,也可用浓硫酸代替浓盐酸
D. 把过量Cu放入少量的稀硝酸中至完全反应后,再加入稀硫酸可以产生气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铜粉放入稀硫酸中,加热后无明显现象,但当加入某物质后,铜粉质量减少,溶液呈蓝色且有气体逸出,此物质是( )
A. Na2CO3 B. KNO3 C. NaOH D. HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)向CuSO4溶液中逐滴滴加氨水至过量,过程中会先有沉淀生成,后沉淀逐渐溶解。
①写出沉淀溶解过程的离子方程式___________________。
②Cu2+基态时核外电子排布式为____________________。
③金属铜采取_____堆积。
④NH3分子空间构型为__________________。
(2)制备CrO2Cl2的反应为:K2Cr2O7+3CCl4=2KC1+2CrO2Cl2+3COC12↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是_____________(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为_____,中心原子的杂化方式为____________________。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相似,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm,则熔点:NiO____FeO(填“>”、“<”或“=”)。
(4)Ni和La的合金是目前使用广泛的储氢材料。具有大容量、高寿命、耐低温等特点,在日本和中国己实现了产业化。该合金的晶胞结构如下图所示。

①该晶体的化学式为_______________________。
②已知该晶胞的摩尔质量为Mg/mol,密度为dg·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是_________cm3(用含M、d、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B,C形成电子总数为10的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数为18的气体分子。请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关);
(1)A~F六种元素原子,原子半径最大的是_____(填元素符号),B元素在元素周期表中的位置________。
(2)D与E可形成化合物D2E,该化合物的电子式为________。
(3)A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与铜单质反应,该反应的化学方程式为__________。
(4)比较E、F气态氢化物的较稳定的是:________(用分子式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 足量的Fe在Cl2中燃烧只生成FeCl3
B. 铁的化学性质比较活泼,它能和水蒸气反应生成H2和Fe(OH)3
C. 用酸性KMnO4溶液检验FeCl3溶液中是否含有FeCl2
D. 向某溶液中加NaOH溶液得白色沉淀,且颜色逐渐变为红褐色,说明该溶液中只含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有K+、Na+、Fe3+、Fe2+、SO42-、CO32-、I-、Cl-中的一种或多种,进行如图所示的实验,下列说法正确的是 ( )
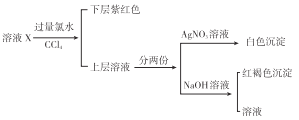
A. 溶液X中有Fe3+、SO42-
B. 溶液X中有Fe2+、I-可能有SO42-、Cl-
C. 溶液X中有I-、Cl-,无CO32-
D. 溶液X中有I-,Fe2+和Fe3+两种离子中至少有一种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com