
 高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.| 滴入高锰酸钾溶液的次序(每滴溶液的体积相同) | 高锰酸钾溶液紫色褪去的时间 |
| 先滴入第1滴 | 1min |
| 褪色后再滴入第2滴 | 15s |
| 褪色后再滴入第3滴 | 3s |
| 褪色后再滴入第4滴 | 1s |
 =0.01mol,则:
=0.01mol,则:

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.| 滴入高锰酸钾溶液的次序(每滴溶液的体积相同) | 高锰酸钾溶液紫色褪去的时间 |
| 先滴入第1滴 | 1min |
| 褪色后再滴入第2滴 | 15s |
| 褪色后再滴入第3滴 | 3s |
| 褪色后再滴入第4滴 | 1s |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年黑龙江省高三上学期期中考试化学试卷(解析版) 题型:实验题
研究氧化还应常用到高锰酸钾,高锰酸钾是一种重要的化学试剂。为了增强其氧化性常将其酸化,但在酸性条件下其水溶液不很稳定,会分解生成二氧化锰和氧气,而在中性或弱碱性溶液中分解速度很慢,见光分解速度加快。
(1)高锰酸钾溶液保存的注意事项______________________________________________。
酸性溶液中高锰酸钾分解的离子方程式 _______________________________________。
(2)草酸可使酸性高锰酸钾溶掖褪色,请写出此反应的离子方程式______________________。
(3)某学习小组为了探究高锰酸钾溶液和草酸钠溶液的反应过程,将高锰酸钾溶液逐滴地滴入一定体积的酸性草酸钠溶液中(温度相同,并不断振荡时),记录的现象如下表:
|
滴入 KMnO4 认溶液的次序(每滴溶液等体积) |
KMnO4 溶液紫色褪去的时间 |
|
先滴入第 1 滴 |
1min |
|
褪色后再滴入第 2 滴 |
15s |
|
褪色后再滴入第 3 滴 |
3s |
|
褪色后再滴入第 4 滴 |
1s |
请分析高锰酸钾溶液褪色时间变化的原因________________________________________。
(4)该学习小组在获取了上述经验和结论以后,用稳定的物质草酸钠来标定高锰酸钾济液的浓度。他们准确称取2.680g纯净的草酸钠配成500mL溶液,每次准确量取25.00mL溶液酸化后用KMnO4 溶液滴定。
①高锰酸钾溶液应装在______(填下途中的仪器编号)。

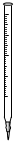
甲 乙 丙 丁
②为了防止高锰酸钾在酸性条件下分解而造成误差,滴定开始时,操作上必须是______________。
③当溶液呈微红色且半分钟内不褪色,消耗KMnO4溶液20.00mL(多次测定的平均值),则KMnO4溶液的浓度为________________。
(附原子相对质量K=39Mn=55O=16 Na=23C=12)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省高三上学期第三次月考化学试卷(解析版) 题型:实验题
高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快。
(1)酸性条件下高锰酸钾溶液分解的离子方程式 。
(2)请配平高锰酸钾溶液与草酸钠Na2C2O4溶液在酸性条件下反应的离子方程式:
______MnO4— +______C2O42—+______H+=______Mn2++______CO2↑+____________
(3)某学习小组为了探究高锰酸钾溶液和草酸钠溶液的反应过程,将高锰酸钾溶液逐滴地滴入一定体积的酸性草酸钠溶液中(温度相同,并不断振荡时),记录的现象如下表:
滴入高锰酸钾溶液的次序(每滴溶液的体积相同) |
高锰酸钾溶液紫色褪去的时间 |
|
先滴入第1滴 |
1min |
|
褪色后再滴入第2滴 |
15s |
|
褪色后再滴入第3滴 |
3s |
|
褪色后再滴入第4滴 |
1s |
请分析高锰酸钾溶液褪色时间变化的原因 。
(4)该学习小组在获取了上述经验和结论以后,用稳定的物质草酸钠Na2C2O4(相对分子质量134.0)来标定高锰酸钾溶液的浓度。他们准确称取1.340g纯净的草酸钠配成250mL溶液,每次准确量取25.00mL溶液酸化后用KMnO4溶液滴定。
①高锰酸钾溶液应装在 (填下图中的仪器编号)。

②为了防止高锰酸钾在酸性条件下分解而造成误差,滴定时应注意的是 。
③若在实验过程中存在下列操作,其中会使所测KMnO4浓度偏低的是 。
A.未润洗盛放KMnO4的滴定管
B.滴定前尖嘴部分无气泡,滴定终点时出现气泡
C.定容时,俯视刻度线
D.锥形瓶用水洗之后未用待测液润洗
④当溶液呈微红色且半分钟内不褪色,消耗KMnO4溶液20.00mL(多次测定的平均值),则KMnO4溶液的浓度为 。
查看答案和解析>>
科目:高中化学 来源:2014届安徽省皖南八校高三第一次联考化学试卷(解析版) 题型:填空题
高锰酸钾是一种重要的化工产品。如图是工业上用软锰矿制备高锰酸钾的一种工艺流程。
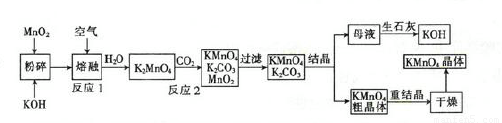
(1)KMnO4稀溶液是一种常用的消毒剂,其消毒机理与(填字母)相似。
A.75%酒精 B.O3 C.二氧化硫 D.漂白粉
(2)写出上述流程中反应2的化学方程式:__
(3)上述流程中可以循环使用的物质有CO2、 和 。(填化学式)
(4)若不考虑制备过程中的损失和整套装置的物质循环,则1 molMnO2可制得___gKMnO4。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com