
分析 依据质量换算物质的量,结合化学方程式对应的物质的量计算反应放出的热量,依据热化学方程式书写方法,标注物质聚集状态和反应焓变写出,由此分析解答.
解答 解:当0g丁烷完全反应物质的量$\frac{10g}{58g/mol}$=$\frac{10}{58}$mol,完全燃烧并生成二氧化碳和液态水时,放出热量为5×102kJ,1mol丁烷完全反应放热=$\frac{\frac{1×500}{10}}{58}$=2900KJ,依据反应物和产物状态标注聚集状态和对应量下的反应热,书写的热化学方程式为:2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l)△H=-5800kJ/mol;
故答案为:2900KJ;2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l)△H=-5800kJ/mol.
点评 本题考查了热化学方程式的书写方法和计算应用,题目较简单,注意焓变计算和物质聚集状态的标注.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 CO2+4HCl.
CO2+4HCl.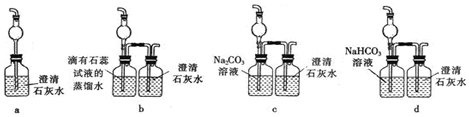
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
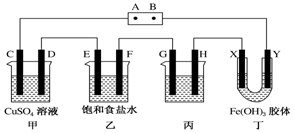
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
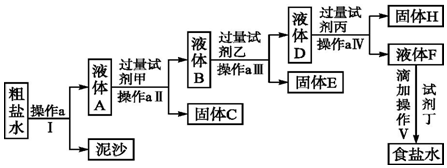
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下,11.2L 氟化氢中含有的分子数目为0.5NA | |
| B. | 室温下,21.0g乙烯和丁烯的混合气体中所含的碳原子数目是NA | |
| C. | 室温下,2L0.05mol/L 的NH4NO3溶液中所含有的氮原子数目是0.2NA | |
| D. | 22.4L Cl2 与足量NaOH溶液反应时转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X只能是第二周期的元素 | B. | a一定比b小 | ||
| C. | b-a+m+n一定等于16 | D. | Y只能是第三周期的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
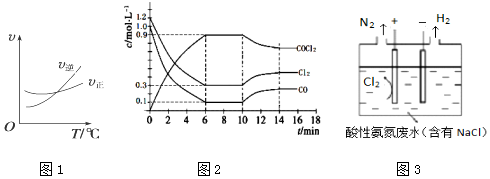
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com