
| A、常温下,Cu-Zn原电池中,正极产生1.12L H2时,转移的电子数应为0.1NA |
| B、12g金刚石中含有的共价键数为4NA |
| C、2g D2O中所含中子数为NA |
| D、常温下,1L 0.1mol/L Na2CO3溶液中,含有CO32-数为0.1NA |
| 1 |
| 2 |
| 1 |
| 2 |


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
| 选项 | 事实 | 解释 |
| A | 用铝罐槽车储运浓硫酸 | 浓硫酸的强氧化性使铝钝化 |
| B | 用饱和NH4Cl溶液处理过的舞台布帘可防火 | NH4Cl分解吸热,且分解产物能隔绝空气中的氧气 |
| C | 钠元素的焰色反应呈黄色 | Na2O2是一种淡黄色的固体 |
| D | SO2能使溴水褪色 | SO2具有还原性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 不纯物 | 除杂试剂 | 分离方法 |
| A | CH4(C2H4) | 酸性KMn04溶液 | 洗气 |
| B | 苯中的少量苯酚 | NaOH溶液 | 分液 |
| C | 福尔马林(甲酸) | NaOH溶液 | 分液 |
| D | 乙酸乙酯(乙酸) | 饱和的碳酸钠溶液 | 过滤 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由于氢键的作用,使NH3、H2O、HF的沸点反常,且沸点高低顺序为HF>H2O>NH3 |
| B、氢键只能存在于分子间,不能存在于分子内 |
| C、在固态水(冰)中,水分子间氢键数目增多,造成体积膨胀,密度减小 |
| D、相同量的水在气态、液态和固态时均有氢键,且氢键的数目依次增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在一定条件下可发生加成反应 |
| B、分子中N≡C键的键长大于C-C键的键长 |
| C、分子中含有2个σ键和4个π键 |
| D、不和氢氧化钠溶液发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丙烯与氯化氢在一定条件下制取2-氯丙烷 |
| B、酒精与浓硫酸混合液迅速升温至170℃的反应 |
| C、甲烷制四氯化碳 |
| D、甲烷与氧气的混合气体在点燃下的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
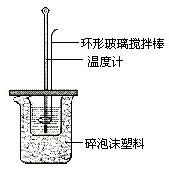 已知测定中和热的实验步骤如下:①量取30mL 0.5mol/L硫酸倒入小烧杯中,测量温度; ②量取50mL 0.5mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.回答下列问题
已知测定中和热的实验步骤如下:①量取30mL 0.5mol/L硫酸倒入小烧杯中,测量温度; ②量取50mL 0.5mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.回答下列问题查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com