
| A. | 金刚石>NaCl>O2 | B. | F2>Cl2>Br2 | C. | S>NaBr>金刚石 | D. | SiH4<CH4<干冰 |
分析 比较依据是:原子晶体>离子晶体>分子晶体.对于离子晶体来说,离子键越强,物质的熔、沸点越高;其中组成相似的离子化合物,其离子键的强弱主要决定于离子的电荷数跟离子半径之比,离子半径越小,电荷数越大,形成的离子键越强,熔、沸点就越高.对于分子晶体来说,分子间作用力越大,物质的熔、沸点就越高,其中组成和结构相似的分子晶体,分子间作用力一般随着式量的增大而增强,熔、沸点则逐渐升高.
解答 解:A、三种晶体中金刚石为原子晶体,氯化钠为离子晶体,氧气为分子晶体,原子晶体>离子晶体>分子晶体,故A正确;
B、三种晶体都为分子晶体,分子间作用力越大,物质的熔、沸点就越高,正确顺序应为:F2<Cl2<Br2,故B错误;
C、三种晶体中,S为分子晶体,溴化钠为离子晶体,金刚石为原子晶体,原子晶体>离子晶体>分子晶体,正确顺序为:S<NaBr<金刚石,故C错误.
D、三种晶体都为分子晶体,分子间作用力越大,物质的熔、沸点就越高,正确顺序应为SiH4>干冰>CH4,故D错误.
故选A.
点评 本题考查不同晶体熔沸点高低的比较,题目难度不大,注意同种晶体和不同晶体熔沸点高低比较的方法和角度.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:填空题
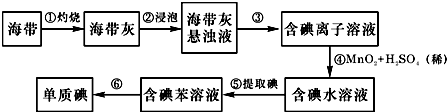
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜极为负极 | B. | 电子从铜沿导线转移到铁 | ||
| C. | 铁表面析出金属铜 | D. | 总反应为Fe+CuSO4=FeSO4+Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
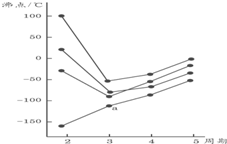
| A. | H2S | B. | CH4 | C. | PH3 | D. | SiH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 mol•L-1氨水 | B. | 4 mol•L-1 HNO3 | ||
| C. | 8 mol•L-1 NaOH | D. | 18 mol•L-1 H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com