
分析 ①二氧化碳少量,反应生成碳酸钙和水;
②氢氧化钡过量,二者反应生成硫酸钡、氢氧化钠和水;
③硫酸氢钠在熔融状态下完全电离生成钠离子和硫酸氢根离子.
解答 解:①少量二氧化碳通入澄清石灰水,离子方程式:CO2+Ca2++2OH-=CaCO3↓+H2O;
故答案为:CO2+Ca2++2OH-=CaCO3↓+H2O;
②硫酸氢钠与过量氢氧化钡溶液混合反应生成硫酸钡、氢氧化钠和水,离子方程式:H++SO42-+Ba2++OH-=BaSO4↓+H2O;
故答案为:H++SO42-+Ba2++OH-=BaSO4↓+H2O;
③硫酸氢钠在熔融状态下完全电离生成钠离子和硫酸氢根离子,电离方程式:NaHSO4=Na++HSO4-,
故答案为:NaHSO4=Na++HSO4-.
点评 本题考查了离子方程式、电解质电离方程式的书写,明确反应实质是解题关键,注意反应物用量对反应的影响,注意熔融状态下硫酸氢钠只断裂离子键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 紧闭门窗,防止装修面干裂或变质 | |
| B. | 适度开窗通风,充分进行室内外空气对流 | |
| C. | 请专业环境监测人员进行检测 | |
| D. | 在各个房间均匀地适量放置吊兰、芦荟等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气的燃烧热为285.5KJ/mol,则电解水的热化学方程式为2H2O(l)$\frac{\underline{\;电解\;}}{\;}$ 2H2(g)+O2(g)△H=+285.5KJ/mol | |
| B. | 已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ/mol 则稀H2SO4溶液和稀Ba(OH)2溶液反应的反应热△H=2×(-57.3)KJ/mol | |
| C. | 在CO2中,Mg燃烧生成MgO和C,该反应中化学能全都转化为热能 | |
| D. | 已知AX3的熔点和沸点分别为一93.6℃和76℃,AX5的熔点为167℃.室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 KJ/mol.该反应的热化学方程式为AX3(l)+X2(g)=AX5(s)△H=一123.8 KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
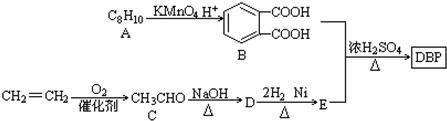
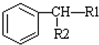 $\stackrel{KMnO_{2}H+}{→}$
$\stackrel{KMnO_{2}H+}{→}$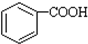
 (-R1、-R2表示氢原子或烃基)
(-R1、-R2表示氢原子或烃基)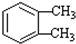 ,D→E的反应类型加成(或还原)反应.
,D→E的反应类型加成(或还原)反应.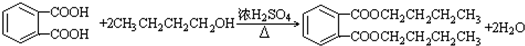 .
.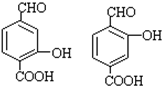 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 原子半径 | 电负性 | 第一电离能 |
| C | 67pm | 2.55 | 1125.8kJ/mol |
| S | 88pm | 2.58 | 1036.7kJ/mol |
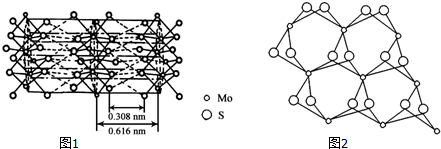
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热灼烧海带时要在蒸发皿中进行 | |
| B. | 蒸馏时,水从冷凝管上部通入,从下部流出 | |
| C. | 向某溶液中加入AgNO3溶液,生成白色沉淀,该溶液一定含有Cl- | |
| D. | 分液时,碘的四氯化碳溶液从分液漏斗下口放出,水层从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性:X->Y- | |
| B. | 在X-、Y-、Z-、W- 中 Z- 的还原性最强 | |
| C. | 氧化性:Z2>W2 | |
| D. | 反应2Z-+Y2=2Y-+Z2可以发生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com