
分析 (1)赤铁矿的主要成分为氧化铁,工业上用一氧化碳还原赤铁矿冶炼铁,同时生成二氧化碳,根据元素守恒书写化学方程式;
(2)在氧化还原反应中元素化合价降低的作氧化剂,根据氧化还原反应方程中元素的化合价的变化等于转移电子数目进行判断;
(3)刻制印刷电路时,用FeCl3溶液与铜反应生成亚铁离子和铜离子,根据电荷守恒和元素守恒书写反应的离子方程.
解答 解:(1)赤铁矿的主要成分为氧化铁,化学式为Fe2O3,工业上用一氧化碳还原赤铁矿冶炼铁,同时生成二氧化碳,反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2 ,
故答案为:Fe2O3;Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2 ;
(2)在反应14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4中,铜从+2价降为+1价,硫从-1价降为-2价,所以反应中氧化剂为CuSO4和FeS2,反应中化合价降低的总数为14×1+7×1=21,即当有5molFeS2发生反应时,电子转移的物质的量为21mol,数目为21NA,
故答案为:CuSO4和FeS2;21NA;
(3)刻制印刷电路时,用FeCl3溶液与铜反应生成亚铁离子和铜离子,反应的离子方程为Cu+2Fe3+=2Fe2++Cu2+,
故答案为:Cu+2Fe3+=2Fe2++Cu2+.
点评 本题综合考查元素化合物、氧化还原反应分析等,为高考常见题型,把握发生的化学反应为解答的关键,侧重氧化还原反应的考查,注意离子反应的书写方法,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
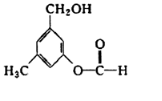 有机物A的结构简式如图所示,某同学对其可能具有的化学性质进行了如下预测,其中正确的是( )
有机物A的结构简式如图所示,某同学对其可能具有的化学性质进行了如下预测,其中正确的是( )| A. | ①②③ | B. | ①③⑤ | C. | ①②④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:4:2 | B. | 2:3:3 | C. | 6:3:1 | D. | 2:3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com