
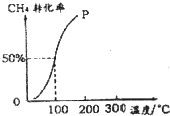
 甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.
甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.
| ||
| △t |
| 1 |
| 2 |
| ||
| 5min |
| 0.005×0.0153 |
| 0.005×0.015 |
| 1 |
| 2 |
| c(H2) |
| c(CH3OH) |


 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
| A、若V1>V2,c1=c2,则混合溶液的PH>7 |
| B、若混合溶液的PH=7,则c1V1<c2V2 |
| C、若c1=c2,混合溶液中c(NH4+)=c(Cl-),则V1>V2 |
| D、以上说法均不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7a:10d |
| B、10a:7d |
| C、10b:7e |
| D、7e:11b |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2和NO2溶于水都显酸性,因而它们都是酸性氧化物 |
| B、Na2O和NH3的水溶液均能导电,故均为电解质 |
| C、Si和SiO2均属于原子晶体 |
| D、Na2O和Na2O2与水反应均会生成强碱,故都是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同温度同物质的量浓度时,HF比HCN电离平衡常数大,则NaF溶液的pH比NaCN溶液大 |
| B、0.2 mol?L-1 NH4Cl和0.1 mol?L-1 NaOH溶液等体积混合后:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+) |
| C、物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| D、同浓度的下列溶液中,①NH4Al(SO4)2 ②NH4Cl ③CH3COONH4 ④NH3?H2O;c(NH4+) 由大到小的顺序是:③>②>①>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
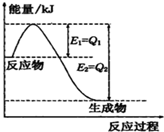 ①一定条件下,N2和H2反应生成lmolNH3过程中能量变化如图所示,则1mol N2完全反应时的焓变为:
①一定条件下,N2和H2反应生成lmolNH3过程中能量变化如图所示,则1mol N2完全反应时的焓变为:查看答案和解析>>
科目:高中化学 来源: 题型:
 将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:
将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:| 实验编号及其目的 | V(容积)/L | t/℃ | n(A起始)/mol | n(B起始)/mol | 催化剂的质量/g | 催化剂的表面积/m2?g-1 |
| 实验1 参照对比实验 | 2 | 80 | 1.2 | 0 | a | b |
| 实验4:催化剂的表面积对反应速率的影响 | ||||||
| 实验5目的: | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com