
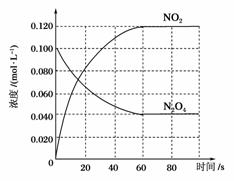
在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深 。
。
回答下列问题:
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为__________mol·L-1·s-1,反应的平衡常数K1为______________。
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是______________________________。
②列式计算温度T时反应的平衡常数K2______________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由______________________________________________________ ___________ _______________。
解析 (1)由题意及图示知,在1.00 L的容器中,通入0.100 mol的N2O4,发生反应:N2O4(g)2NO2(g),随温度升高混合气体的颜色变深,说明反应向生成NO2的方向移动,即向正反应方向移动,所以正反应为吸热反应,即ΔH>0;由图示知60 s时该反应达到平衡,消耗N2O4为0.100 mol·L-1-0.040 mol·L-1=0.060 mol·L-1,根据v=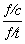 可知:v(N2O4)=
可知:v(N2O4)=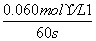 =0.001 0 mol·L-1·s-1;求平衡常数
=0.001 0 mol·L-1·s-1;求平衡常数
可利用三段式:
N2O4(g)2NO2(g)
起始量/(mol·L-1) 0.100 0
转化量/(mol·L-1) 0.060 0.120
平衡量/(mol·L-1) 0.040 0.120
K1=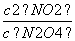 =
=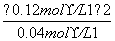 =0.36 mol·L-1
=0.36 mol·L-1
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)降低,说明平衡N2O4(g)2NO2(g)向正反应方向移动,根据勒夏特列原理,温度升高,向吸热反应方向移动,即向正反应方向移动,故T>100 ℃,由c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡,可知此时消耗N2O4 0.002 0 mol·L-1·s-1×10 s=0.020 mol·L-1,由三段式:
N2O4(g)2NO2(g)
起始量/(mol·L-1) 0.040 0.120
转化量/(mol·L-1) 0.020 0.040
平衡量/(mol·L-1) 0.020 0.160
K2=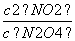 =
=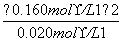 ≈1.3 mol·L-1
≈1.3 mol·L-1
(3)温度T时反应达到平衡后,将反应容器的容积减少一半,压强增大,平衡会向气体体积减小的方向移动,该反应逆反应为气体体积减小的反应,故平衡向逆反应方向移动。
答案 (1)大于 0.001 0 0.36 mol·L-1
(2)大于
反应正方向吸热,反应向吸热方向进行,故温度升高
平衡时,c(NO2)=0.120 mol·L-1+0.002 0 mol·L-1·s-1×10 s×2=0.160 mol·L-1
c(N2O4)=0.040 mol·L-1-0.002 0 mol·L-1·s-1×10 s=0.020 mol·L-1
K2=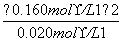 ≈1.3 mol·L-1
≈1.3 mol·L-1
(3)逆反应 对气体分子数增大的反应,增大压强平衡向逆反应方向移动


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
在下列实验方法中,不能证明醋酸是弱酸的是( )
A.25 ℃时,醋酸钠溶液呈碱性
B.25 ℃时,0.1mol·L-1的醋酸的pH约为3
C.25 ℃时,等体积的盐酸和醋酸,前者比后者的导电能力强
D.25 ℃时,将pH=3的盐酸和醋酸稀释成pH=4的溶液,醋酸所需加入的水多
查看答案和解析>>
科目:高中化学 来源: 题型:
某氯原子的质量是a g,12C原子的质量是b g,用NA表示阿伏加德罗常数,下列说法中正确的是( )
①氯元素的相对原子质量一定是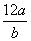 ②m g该氯原子的物质的量一定是
②m g该氯原子的物质的量一定是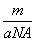 mol ③该氯原子的摩尔质量是aNA g/mol ④a g该氯原子所含质子数是17 mol
mol ③该氯原子的摩尔质量是aNA g/mol ④a g该氯原子所含质子数是17 mol
A.①③ B.②④
C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:

室温下,抽去如图所示装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好,上下两个集气瓶的容积分别为1.2V L、VL)。下列说法正确的是( )
A.反应后各瓶内压强均是反应前的1/10
B.装置中氢元素的总质量为0.42 g
C.生成物的分子总数为0.1NA
D.体系内自发地进行了一种熵减、焓增的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
运用相关化学知识进行判断,下列结论错误的是( )
A.某吸热反应能自发进行,因此该反应是熵增反应
B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中
C.可燃冰主要是甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底
D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中发生反应:2X(g)+Y(g)aZ(g) ΔH=Q kJ·mol-1,开始按体积比2:1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图象,下列有关说法正确的是( )
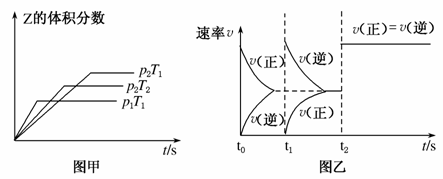
A.图甲,p1>p2,a<3
B.图甲,T1<T2,Q>0
C.图乙,t1时表示恒温、恒压条件下,向平衡体系中充入一定量的Z气体
D.图乙,如果a=3,t2时表示向体系中加入了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25 ℃时有关弱酸的电离平衡常数如下表:
| 弱酸化学式 | HX | HY | H2CO3 |
| 电离平衡常数 | 7.8×10-9 | 3.7×10-15 | K1=4.3×10-7 K2=5.6×10-11 |
下列推断正确的是( )
A.HX、HY两种弱酸的酸性:HX>HY
B.相同条件下溶液的碱性:NaX>Na2CO3>NaY>NaHCO3
C.结合H+的能力:CO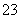 >Y->X->HCO
>Y->X->HCO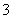
D.HX和HY酸性相同,都比H2CO3弱
查看答案和解析>>
科目:高中化学 来源: 题型:
根据Fe3++AgFe2++Ag+,可用Fe3+做刻蚀液将试管中的银镜洗去。
(1)FeCl3溶液显酸性,原因是________(用离子方程式表示)。
(2)关于FeCl3溶液洗银后的相关叙述正确的是________(填选项字母)。
a.铁元素质量减小 b.c(Fe3+)减小
c.c(Cl-)不变
(3)用Fe(NO3)3溶液洗银后,某同学欲从洗银废液(含Fe3+、Fe2+、Ag+、NO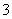 )中回收银,设计了如下路线:
)中回收银,设计了如下路线:
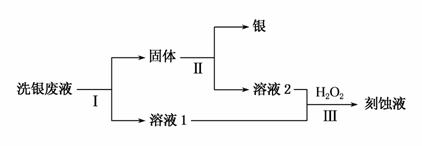
①过程Ⅰ中反应的离子方程式是__________________________。
②过程Ⅱ中加入的试剂可以是_____________________。
③过程Ⅲ中发生反应的离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(右图中的△H表示生成1mol产物的数据)。
(1)P和Cl2反应生成PCl3的热化学方程式_____________________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式______________________________________,
(3)P和Cl2分两步反应生成1molPCl5的
△H3=_________,P和Cl2一步反应生成1molPCl5的△H4__________△H3 (填“大于”、“小于”或“等于”)。
(4)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com