
分析 (1)根据n=$\frac{m}{M}$,硫酸铜的质量计算物质的量;
(2)根据溶液的质量和密度结合V=$\frac{m}{ρ}$计算溶液的体积;再根据c=$\frac{n}{V}$可得物质的量浓度;
(3)根据溶液稀释前后溶质的物质的量不变计算体积.
解答 解:(1)CuSO4的物质的量为:n=$\frac{12.5g}{250g/mol}$=0.05 mol,
答:溶液中CuSO4的物质的量为0.05 mol;
(2)溶液的体积为:V=$\frac{27.5g+12.5g}{1.21g/c{m}^{3}}$=$\frac{40}{1.21}$mL,该溶液中CuSO4的物质的量浓度为:c=$\frac{0.05mol}{\frac{40}{1.21}×1{0}^{-3}L}$=1.51mol/L;
答:该溶液中CuSO4的物质的量浓度为1.51mol/L;
(3)取出溶液中含溶质硫酸铜的物质的量为:n=cV=1.51mol/L×0.02L=0.0302mol,
故稀释后溶液的体积为:V=$\frac{n}{c}$=$\frac{0.0302mol}{1.00mol/L}$=0.0302L=30.2mL,
答:稀释后溶液的体积为30.2mL.
点评 本题考查物质的量浓度的有关计算,题目难度中等,明确溶液稀释前后溶质的物质的量不变为解答关键,注意掌握物质的量与物质的量浓度、摩尔质量之间的关系,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | c(Al3+)=0.1mol/L的溶液中:Na+、K+、HS-、SO42- | |
| B. | 使酚酞呈红色的溶液中:K+、Ba2+、I-、NO3- | |
| C. | 由水电离出的c(H+)=10-13mol/L的溶液中:Na+、HCO3-、Cl-、Br- | |
| D. | 加入Al能放出H2的溶液中:Cl-、SO42-、NO3-、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入Ba(NO3)2溶液中能生成BaSO4沉淀 | |
| B. | 在Si02+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2C0的反应中,Si02是氧化剂 | |
| C. | 生铁在潮湿的空气中主要发生析氢腐蚀 | |
| D. | 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色气体,说明该钾盐是K2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
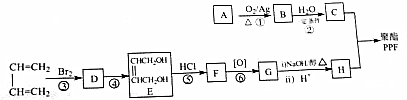

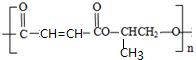 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 使酚酞变红的溶液:Na+、NH4+、SO42-、NO3- | |
| C. | 0.1mol•L-1AgNO3溶液:H+、K+、SO42-、Cl- | |
| D. | 使石蕊变红色的溶液:Mg2+、K+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片上出现铜绿[Cu2(OH)2CO3] | B. | 铁制菜刀生锈 | ||
| C. | 铝锅表面生成致密的氧化膜 | D. | 用醋清理水垢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③④ | C. | ②③④ | D. | ②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com