
| A. | 同周期的ⅡA族与ⅢA族元素的原子序数一定相差1 | |
| B. | 镁、铝、铜、铁、钠五种金属元素中,铜和铁属于过渡元素 | |
| C. | 元素的非金属性越强,其气态氢化物水溶液的酸性越强 | |
| D. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 |
分析 A.元素周期表中,从第四周期开始出现过渡元素,第ⅠA、ⅡA之后是第ⅢB,在第六、七周期中的过渡元素又出现镧系和锕系;
B.铜和铁属于过渡元素;
C.元素的非金属性越强,它的最高价氧化物的水化物酸性越强;
D.同一周期,从左到右,元素的非金属逐渐增强,非金属性越强,最高价氧化物对应水化物的酸性越强.
解答 解:A.因为是同一周期的IIA族,即同一横行往右一个族,在第二、三周期原子序数增加1,因而可以x+1;又因为IIA族与IIIA族元素在第四周期起有过渡元素,因而又可以x+11;在第六、七周期的过渡元素中又出现镧系和锕系,因而又可以x+25,故A错误;
B.镁、铝、铜、铁、钠五种金属元素中,铜和铁属于过渡元素,故B正确;
C.元素的非金属性越强,它的最高价氧化物的水化物酸性越强,而它的气态氢化物水溶液的酸性没有此递变规律,故C错误;
D.第三周期从左到右,元素的非金属逐渐增强,最高价氧化物对应水化物的酸性越强,但如不是最高价,则没有此递变规律,故D错误;
故选B.
点评 本题主要考查了元素周期表的结构和元素周期律,题目难度不大,注意把握元素周期律的递变性和相似性.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LFeCl3溶液中:Fe2+、NH4+、SCN-、SO42- | |
| B. | 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- | |
| C. | 加入铝粉有气泡产生的溶液中:Na+、NH4+、Fe2+、NO3- | |
| D. | 饱和氯水中:K+、Na+、Cl-、HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳和铝 | B. | 硅和钠 | C. | 硼和氮 | D. | 氯和碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢离子浓度 | B. | 水的电离程度 | C. | 水的离子积 | D. | 醋酸浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
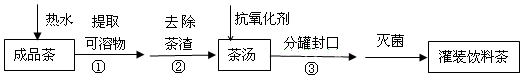
| A. | ①是萃取 | B. | ②是过滤 | ||
| C. | ③是分液 | D. | 维生素C可作抗氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
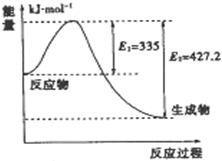 到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com