
氰氨基化钙是一种重要的化工原料,其制备的化学方程式为:CaCO3+2HCN = CaCN2+CO↑+H2↑+CO2↑,下列说法正确的是
| A.CO为氧化产物,H2为还原产物 | B.CaCN2中含有非极性键 |
| C.HCN既是氧化剂又是还原剂 | D.每消耗10g CaCO3生成2.24L CO2 |
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:单选题
根据下列事实:①A+B2+=A2++B;②D+2H2O=D(OH)2+H2↑;③以B、E为电极与E的盐溶液组成原电池,电极反应为E2++2e-=E,B-2e-=B2+,由此可知A2+、B2+、D2+、E2+的氧化性强弱关系是________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:①Na3N+3H2O=3NaOH+NH3↑,②NaH+H2O=NaOH+H2↑。下列叙述正确的是
| A.离子半径:Na+>N3->H+ |
| B.反应①和②都是氧化还原反应 |
| C.反应②每生成1 mol H2,转移的电子数为NA |
| D.Na3N和NaH与盐酸反应都只生成一种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知氧化性KMnO4>HNO3,Bi位于周期表中第ⅤA族,+3价较稳定,KBiO3溶液为无色。取一定量的Mn(NO3)2溶液依次进行下列实验,现象记录如下:
①滴加适量KBiO3溶液,溶液变为紫红色
②继续滴加适量H2O2,紫红色褪去,并有气泡产生
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色
④最后通入足量的SO2气体
请回答下列问题:
(1)KMnO4、KBiO3、H2O2的氧化性由强到弱的顺序是______________________________________。
(2)实验④中的现象为____________________________________________________________。
(3)实验③反应的离子方程式是____________________________________________________。
(提示:该反应须在酸性条件下进行)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应如下:
①4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2CrO4+H2SO4??Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
| A.反应①和②均为氧化还原反应 |
| B.反应①的氧化剂是O2,还原剂是FeO·Cr2O3 |
| C.Na2Cr2O7中Cr元素的化合价为+7 |
| D.反应①中生成1 mol的Na2CrO4时共转移28 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
乙醇与重铬酸根离子在酸性溶液中能发生如下反应:C2H5OH+Cr2O72—+H+―→CO2↑+Cr3++H2O,当这个方程式配平后,H+的化学计量数为( )
| A.10 | B.12 | C.14 | D.16 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某研究小组在实验室用重晶石(主要成分BaSO4)对工业生产BaS进行模拟实验。BaS是可溶盐,在工业生产中,它是制备其他钡盐的中间产物。已知:
BaSO4(s)+4C(s)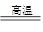 4CO(g)+BaS(s) ΔH1=+571.2 kJ·mol-1 ①
4CO(g)+BaS(s) ΔH1=+571.2 kJ·mol-1 ①
BaSO4(s)+2C(s)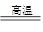 2CO2(g)+BaS(s) ΔH2=+226.2 kJ·mol-1 ②
2CO2(g)+BaS(s) ΔH2=+226.2 kJ·mol-1 ②
下列说法不正确的是( )
| A.上述反应中BaSO4均作氧化剂 |
B.反应C(g)+CO2(g)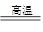 2CO(g)的ΔH3>+172.5 kJ·mol-1 2CO(g)的ΔH3>+172.5 kJ·mol-1 |
| C.实际生产中必须加入过量的炭使BaSO4得到充分的还原,同时还要通入空气,因为①②为吸热反应,炭和氧气反应放热维持反应所需高温 |
| D.以BaS作为沉淀剂,用于铅和汞沉淀的转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
科学家从化肥厂生产的(NH4)2SO4中检验出组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子形式存在,植物的根系极易吸收N4H44+,但它遇到碱时,会生成一种形似白磷的N4分子。N4分子不能被植物吸收。下列有关说法不正确的是( )
| A.N4和N2互为同素异形体 |
| B.14N与14C互为同位素 |
| C.N4H4(SO4)2不能与草木灰混合使用 |
| D.8NH3+4C5OH=N4+4C5NH2+6H2+4H2O,此反应中每生成5.6 g N4时转移1.2 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将一定量的锌与100 mL 18.5 mol/L的浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液中c(H+)="0.1" mol/L,则下列叙述中错误的是( )
| A.反应中消耗的Zn的质量为97.5 g |
| B.气体A中SO2和H2的体积比为1∶4 |
| C.反应中被还原的元素只有一种 |
| D.反应中共转移电子3 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com