
| A. | 氧化镍高温分解 | B. | 电解熔融的氧化镍 | ||
| C. | 高温下用氢气还原氧化镍 | D. | 高温下用焦炭还原氧化镍 |
分析 金属冶炼是工业上将金属从含有金属元素的矿石中还原出来的生产过程.金属的活动性不同,可以采用不同的冶炼方法.
金属冶炼的方法主要有:
热分解法:对于不活泼金属,可以直接用加热分解的方法将金属从其化合物中还原出来(Hg及后边金属);
热还原法:在金属活动性顺序表中处于中间位置的金属,通常是用还原剂(C、CO、H2、活泼金属等)将金属从其化合物中还原出来(Zn~Cu);
合电解法:活泼金属较难用还原剂还原,通常采用电解熔融的金属化合物的方法冶炼活泼金属(K~Al).
解答 解:金属铁的冶炼采用热还原法,
A.依据金属冶炼可知不活泼金属利用其氧化物分解法,故A错误;
B.电解法适用于活泼金属的冶炼,故B错误;
C.镍的金属活动性介于铁和锡之间,类似金属铁的冶炼采用热还原法,氧化镍矿为原料制得高纯度的金属镍的冶炼方法为热还原法,故C正确;
D.焦炭还原氧化镍会引入杂质碳,故D错误;
故选C.
点评 本题考查了金属冶炼的一般原理,题目难度不大,注意根据金属的活泼性不同采取相应的冶炼方法.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:解答题
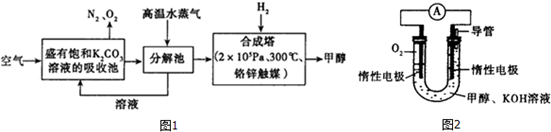
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需要的时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ③④⑥ | C. | ②③⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “地沟油”经过加工处理后,可以用来制肥皂 | |
| B. | “亚硝酸盐”可作某些食品的添加剂 | |
| C. | “84”消毒液的有效成分是NaClO | |
| D. | SO2用作食品增白剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 物质 | 单晶桂 | 漂白液 | 小苏打 | 铁红 |
| 有效成分 | Si | NaClO | NaHCO3 | Fe2O3 |
| 用途 | 做光导纤维 | 做消毒剂 | 灭火器 | 做涂料 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| W | 氮 | Y | |
| X | 硫 | Z |
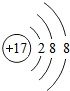 ;写出工业生产X单质粗产品的化学方程式:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO.
;写出工业生产X单质粗产品的化学方程式:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在常温下就容易被氧化 | |
| B. | 钠在空气中燃烧生成Na2O | |
| C. | 钠与氧气化合时作还原剂 | |
| D. | 钠在自然界中只能以化合物的形式存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com