
| A. | 2A+2B?3C+D | B. | 3A+2B?2C+D | C. | 2A+B?3C+D | D. | 3A+B?2C+2D |
科目:高中化学 来源: 题型:选择题
| A. |  证明非金属性强弱S>C>Si | |
| B. |  制备并收集少量NO气体 | |
| C. |  制取并收集干燥纯净的NH3 | |
| D. |  制备Fe(OH)2并能较长时间观察其颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
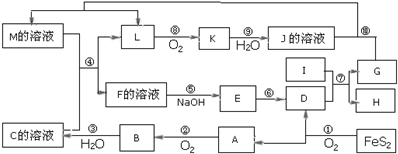
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,0.2molSO2与足量O2充分反应,生成SO3分子数为0.2NA | |
| B. | 常温常压下,4.4gCO2与N2O混合气体中含有的原子总数为0.3NA | |
| C. | 标准状况下,2.24LCl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA | |
| D. | 标准状况下,22.4L甲苯中含C-H数目为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高温电解技术可将释放的CO2转化为具有工业利用价值的产品.反应方程式为CO2+H2O$\frac{\underline{\;电解\;}}{高温}$CO+H2+O2,其工作原理示意图如图.电极b上放出的气体X为O2,电极b连接Y为电源的正极(填正、负).
高温电解技术可将释放的CO2转化为具有工业利用价值的产品.反应方程式为CO2+H2O$\frac{\underline{\;电解\;}}{高温}$CO+H2+O2,其工作原理示意图如图.电极b上放出的气体X为O2,电极b连接Y为电源的正极(填正、负).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/s | 0 | 500 | 1 000 |
| c(H2)/mol•L-1 | 5.00 | 3.52 | 2.48 |
| c(CO)/mol•L-1 | 2.50 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com