
已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H1=﹣Q1,H2(g)+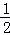 O2(g)═H2O(g);△H2=﹣Q2,H2(g)+
O2(g)═H2O(g);△H2=﹣Q2,H2(g)+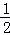 O2(g)═H2O(l);△H3=﹣Q3,常温下取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况)经完全燃烧恢复到常温,放出的热量为()
O2(g)═H2O(l);△H3=﹣Q3,常温下取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况)经完全燃烧恢复到常温,放出的热量为()
A. 0.4Q1+0.05Q2 B. 0.4Q1+0.1Q2 C. 0.4Q1+0.05Q3 D. 0.4Q1+0.1Q3
考点: 有关反应热的计算.
分析: 根据混合气体的体积计算混合气体的物质的量,结合气体体积比计算甲烷、氢气的物质的量,再根据热化学反应方程式计算放出的热量.注意燃烧后恢复至常温,氢气燃烧放出的热量应选择生成液态水的热化学反应方程式计算.
解答: 解:甲烷和氢气的混合气体11.2L(已折合成标准状况),
所以甲烷和氢气的混合气体的总的物质的量为n=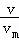 =
= =0.5mol,
=0.5mol,
甲烷和氢气的体积比为4:1,所以甲烷的物质的量为0.5mol×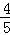 =0.4mol,氢气的物质的量为0.5mol﹣0.4mol=0.1mol.
=0.4mol,氢气的物质的量为0.5mol﹣0.4mol=0.1mol.
由CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=﹣Q1可知,
0.4mol甲烷燃烧放出的热量为0.4mol×Q1kJ/mol=0.4Q1kJ;
由H2(g)+ O2(g)═H2O(l);△H3=﹣Q3,可知,0.1mol氢气燃烧生成液态水放出的热量为0.1mol××Q3kJ/mol=0.1Q3kJ.
O2(g)═H2O(l);△H3=﹣Q3,可知,0.1mol氢气燃烧生成液态水放出的热量为0.1mol××Q3kJ/mol=0.1Q3kJ.
所以放出的热量为0.4Q1+0.1Q3.
故选D.
点评: 本题考查根据热化学方程式进行的有关反应热的计算,难度不大,理解热化学方程式的意义是关键,注意室温下水为液体.


科目:高中化学 来源: 题型:
为探讨反应X+YZ中反应速率与反应物浓度的关系,实验测得X、Y的初始浓度(用c表示,mol/L)与生成物Z的浓度达到0.0042mol/L时所需的时间(秒)如右表所示.下列关于该反应反应速率的判断,正确的是()
c(X) c(Y) 所需时间
0.10 0.10 0.60s
0.20 0.10 0.15s
0.20 0.05 0.30s
A. 与c(X)成正比且与c(Y)成正比 B. 与c(X)成正比且与c(Y)无关
C. 与c2(X)成正比且与c(Y)成正比 D. 与c2(X)成正比且与c(Y)成反比
查看答案和解析>>
科目:高中化学 来源: 题型:
共价键、离子键和范德华力都是微观粒子之间的不同作用力,下列物质:①Na2O2、②SiO2、③NH4Cl、④金刚石、⑤CaH2、⑥白磷,其中含有两种结合力的组合是( )
A. ①③⑤⑥ B. ②④⑥ C. ①③⑥ D. ①②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
已知热化学方程式:
2H2O(l)=2H2(g)+O2(g);△H1=+571.6kJ/mol,
2H2(g)+O2(g)=2H2O(g);△H2=﹣483.6kJ/mol.
当1g 液态水变成气态水时,对其热量变化的下列描述:
①放出;②吸收;③2.44kJ;④4.88kJ;⑤88kJ,
其中正确的是()
A. ②和⑤ B. ①和③ C. ②和④ D. ②和③
查看答案和解析>>
科目:高中化学 来源: 题型:
298K,101kPa时,合成氨反应的热化学方程式为:N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.38kJ•mol﹣1.在该温度下,取1mol N2(g)和3mol H2(g)放在一密闭容器中,在催化剂存在进行反应,测得反应放出的热量总是 (填“大于”、“等于”或“小于”)92.38kJ,其原因是 ..
查看答案和解析>>
科目:高中化学 来源: 题型:
火法炼铜得到的粗铜中含多种杂质(如锌、金和银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯.在电解精炼时()
A. 粗铜接电源负极
B. 纯铜作阳极
C. 杂质都将以单质形式沉积到池底
D. 纯铜片增重2.56g,电路中通过电子为0.08mol
查看答案和解析>>
科目:高中化学 来源: 题型:
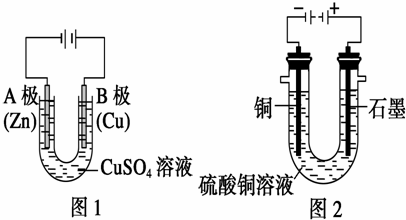
请按要求回答下列问题.
(1)根据图1回答①②:
①A电极可观察到的现象是 物质,电极反应式为 ;B极的电极反应式为 .
②通电一段时间后,CuSO4溶液的浓度 ,pH (填“变大”、“变小”或“不变”).
(2)根据图2回答③④:
③将较纯净的CuSO4溶液放入如图所示的装置中进行电解,石墨电极上的电极反应式为 ,电解反应的离子方程式为 .
④实验完成后,铜电极增重a g,石墨电极产生标准状况下的气体体积 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com