
【题目】在某无色强酸性溶液中,下列各组离子一定能大量共存的是( )
A. NH4+、Fe3+、ClO-、SCN-B. Mg2+、Cu2+、SO42-、NO3-
C. Na+、K+、NO3-、SO42-D. K+、Al3+、CO32-、Cl-
科目:高中化学 来源: 题型:
【题目】某有机物含有C、H、O三种元素,其蒸气密度是相同条件下CH4密度的3.625倍,把1.16g该有机物在O2中充分燃烧,将生成物通过足量碱石灰,碱石灰增重3.72g,又知生成的CO2和H2O的物质的量之比为1:1.该有机物可以使溴水褪色,能和金属钠发生反应生成H2.求:
(1)该有机物的摩尔质量
(2)该有机物的分子式
(3)该有机物的结构简式.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、 X、Y、Z三种常见的短周期元素,可以形成XY2、Z2Y、XY3、Z2Y2、Z2X等化合物。已知Y的离子和Z的离子有相同的电子层结构,X离子比Y离子多1个电子层。试回答:
(1)X在周期表中的位置___________,Z2Y2的电子式_________,含有的化学键____________。
(2)Z2Y2溶在水中的反应方程式为__________________________。
(3)用电子式表示Z2X的形成过程_________________________。
II、以乙烯为原料可以合成很多的化工产品,已知有机物D是一种有水果香味的油状液体。试根据下图回答有关问题:

(4)反应①②的反应类型分别是__________、__________。
(5)决定有机物A、C的化学特性的原子团的名称分别是_____________。
(6)写出图示反应②、③的化学方程式:
②_________________________________________;
③__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,反应2SO2+O2![]() 2SO3,达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4。缩小体积,反应再次达到平衡时,n(O2)=0.8 mol,n(SO3)=1.4 mol,此时SO2的物的量应是( )
2SO3,达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4。缩小体积,反应再次达到平衡时,n(O2)=0.8 mol,n(SO3)=1.4 mol,此时SO2的物的量应是( )
A. 0.4 mol B. 0.6 mol C. 0.8 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D均为短周期元素,它们的原子序数依次递增。 A是最外层为一个电子的非金属元素,C 原子的最外层电子数是次外层的3倍; C和D可形成两种固态化合物,其中一种为淡黄色固体;B和C可形成多种气态化合物。A、B、C三种元素可以形成离子晶体,该晶体中各元素原子的物质的量之比为A:B:C=4:2:3。请回答下列问题:
(1)写出B的原子结构示意图 ,写出C和D形成的淡黄色固体化合物的电子式 。
(2)元素原子的物质的量之比为A:B:C="4:" 2:3 的晶体名称为 , 其水溶液显 性,其反应的离子方程式为 。
(3)请写出A2C和BA3分子中电子数相同,且仍由A、B、C元素中任意两种元素组成的微粒的符号(举两例) 、 。
(4)写出由B、C元素组成且元素原子质量比为B:C=7:12的化合物的化学式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,将2molSO2和1mo O2的混合气体通入一个容积固定的5L密闭容器中,发生如下反应:2SO2(g)+O2 (g) ![]() 2SO3 (g)
2SO3 (g)
(1)若2分钟后,测得O2的浓度为0.1mol/L,则2分钟内O2的平均反应速率为____________。
(2)5分钟后反应达平衡,混合气体的物质的量为2.4mol,则平衡时SO3的物质的量为_______________ 。
(3)达平衡时,SO2的转化率为____________ ,平衡时容器内的压强与起始时的压强之比为___________ 。
(4)若平衡后,向该容器中充入一定量的氩气,化学平衡将_____________ 。(正向移动、逆向移动、不移动);若平衡后,向该容器中再充入2molSO2和1molO2,当反应再次达平衡时,SO2的转化率将____________ (增大、减小、不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国药学家屠哟哟因发现青蒿素及其抗疟疗效,荣获诺贝尔生理学或医学奖。青蒿素结构式如右图所示,下列有关青蒿素研究的说法不正确的是
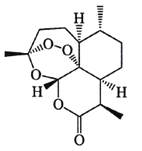
A. 提取过程中为防止破坏青蒿素结构,应避免高温,故采用低沸点溶剂乙酸进行萃取
B. 可使用质谱仪测出这个分子的相对分子质量,也可用紫外光谱确定这个分子的环状结沟
C. 青蒿素是脂溶性的,既可看作是醚类也可看作是酯类,既有氧化性又有还原性
D. 元索分析仪可以确定青蒿素中是否含有C、H、O等元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应C(s) + CO2(g) ![]() 2 CO(g) ΔH > 0,达到平衡状态,现进行如下操作:① 升高反应体系的温度;② 增加反应物C的用量;③ 缩小反应体系的体积;④ 减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的( )
2 CO(g) ΔH > 0,达到平衡状态,现进行如下操作:① 升高反应体系的温度;② 增加反应物C的用量;③ 缩小反应体系的体积;④ 减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的( )
A.①②③④ B.①③ C.④② D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰元素在溶液中主要以Mn2+(很浅的肉色,近乎无色)、MnO42-(绿色)、MnO4-(紫色)形式存在。MnO2不溶于稀硫酸。
(1)将8 mL 0.1 mol·L-1的酸性高锰酸钾溶液和2 mL l.0mol/L的草酸(H2C2O4)溶液在试管中混合,然后将试管置于25℃水浴中,KMnO4溶液浓度随时间变化关系如下图所示。
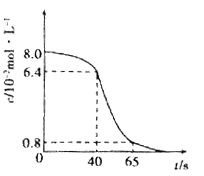
① 写出发生反应的离子方程式:____________
② 计算前40秒用草酸表示的平均反应速率v(草酸)=________________.
③ 40s-65s的反应速率比前40s快,解释原因___________
(2)已知反应3MnO42-+2H2O![]() MnO2+2MnO4-+4OH-。
MnO2+2MnO4-+4OH-。
① 向MnO4-溶液中加入足量稀硫酸,可观察到的现象是__________.
② 常温下,在0.512 mol/L K2MnO4溶液中,当pH=14时K2MnO4的转化率为4/9,则该反应的平衡常数的值为__________
③ 在其他条件不变的条件下,适当升温有利于降低K2MnO4的转化率,则该反应的△H___0(填“大于” “小于”或“等于”)。
(3)碳酸锰是一种重要的工业原料。工业生产中常用复分解法生产MnCO3:
MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O。反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8-7.4. 溶液的pH不能过低也不能过高,原因是_______。设MnSO4溶液为0.19mol/L,则溶液的pH 最高不能超过_________。
[己知MnCO3、Mn(OH)2的Ksp分别为l.8×10-11和1.9×10-13]
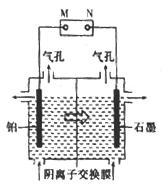
(4)制备单质锰的实验装置如图,阳极以稀硫酸为电解液,阴极以硫酸锰和硫酸混合液为电解液,电解装置中“![]() ”表示溶液中阴离子移动的方向。铂电极的电极反应式为______。
”表示溶液中阴离子移动的方向。铂电极的电极反应式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com