
下图中D经氧化可以得到C,烃G分子中有2个甲基。
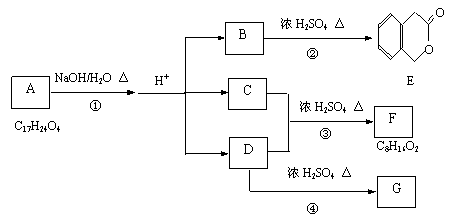 |
根据上图回答下列问题:
(1)B的分子式是_________________。③的反应类型是 。
(2)F的结构简式 ,反应①的化学方程式是(有机物须用结构简式表示):
。
(3)试写出3种C的同分异构体,要求代表除自身类别外3种不同类别的有机物。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
 (2011?南开区一模)能源开发、环境保护、资源利用等是当今社会的热门话题.请根据所学化学知识回答下列问题:
(2011?南开区一模)能源开发、环境保护、资源利用等是当今社会的热门话题.请根据所学化学知识回答下列问题:| 物 质 | CO | H2 | CH3OH |
| 浓度/(mol?L-1) | 1.2 | 1.0 | 0.6 |
| c(CH3OH) |
| c(CO)c2(H2) |
| c(CH3OH) |
| c(CO)c2(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
(1)工业上二氧化钛的制备是: 资料卡片:
物质熔点SiCl4 -70 ℃ 、 TiCl4 -25 ℃;物质沸点SiCl457.6 ℃、TiCl4136.5 ℃
Ⅰ.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4。
Ⅱ.将SiCl4分离,得到纯净的TiCl4。
Ⅲ.在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
Ⅳ.经过滤、水洗除去其中的Cl—,再烘干、焙烧除去水分得到粉体TiO2 。
①在常温下分离TiCl4与SiCl4所采取的操作名称是 ;
②Ⅲ中反应的化学方程式是 ;
③ 检验TiO2·x H2O中Cl-是否被除净的方法是______________________________。
(2)TiO2粒子的大小可以用现代分析仪器测定,而用氧化还原滴定法可测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+ ,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。回答下列问题:
①下列可用于测定TiO2粒子大小的方法是_____________________(填字母代号)。
a.核磁共振法 b.红外光谱法 c.质谱法 d.透射电子显微镜法
②配制NH4Fe(SO4)2标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的_____(填字母代号)。
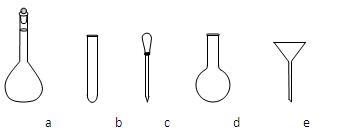
③滴定终点的现象是___________________________________________________。
④滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为_________________________。
⑤若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,对TiO2质量分数测定结果的影响_________________________。(填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
Ⅰ)纯净的过氧化钙(CaO2)难溶于水、乙醇,常温下较为稳定。CaO2·8H2O在0℃时稳定,加热至130℃时逐渐变为无水CaO2。在实验室可用钙盐制取CaO2·8H2O,再经脱水制得CaO2。其制备过程如下:
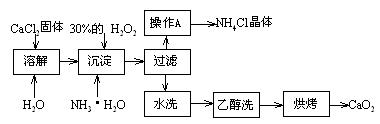
根据以上信息,回答下列问题:
⑴用上述方法制取CaO2·8H2O的化学方程式是_▲_;
⑵测定产品中CaO2的含量的实验步骤是(己知:I2+2S2O32-=2I-+S4O62-):
第一步:准确称取ag产品于锥形瓶中,加入适量蒸馏水和过量的bgKI品体,再滴入适量2mol·L-1的H2SO4溶液,充分反应:
第二步:向上述锥形瓶中加入几滴淀粉溶液:
第三步:逐滴加入浓度为cmol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。
①第三步反应完全时的现象为 ▲ ;
②产品中CaO2的质量分数为 ▲ (用字母表示);
③某同学经实验测得产品中CaO2的质量分数偏高,造成偏高的原因是(测定过程中由操作产生的误差忽略不计,用离子方程式表示) ▲ 。
Ⅱ)硫酸铜是一种重要的化工原料,工业上常用硫酸为原料来制备硫酸铜。
⑴工业上生产硫酸过程中,焙烧硫铁矿时产生的废渣是一种二次资源。
①为了从废渣中磁选获得品位合格的铁精矿,高温下利用CO使弱磁性Fe2O3转化为强磁性Fe3O4。写出该反应的化学方程式_ ▲ _;实验发现:CO太多或太少都会导致磁铁矿产率降低,原因是 ▲ 。
②氯化焙烧工艺是将废渣用氯化钙水溶液调和、成球、高温焙烧,废渣中SiO2与CaCl2等在高温下反应放出HCl,HCl与金属氧化物等反应生成氯化物。反应生成的各金属氯化物以气态形式逸出,进而回收有色金属和回返氯化钙溶液。写出氯化焙烧工艺中生成HCl的化学方程式 ▲ 。
⑵测定硫酸铜品体中结品水含量的实验步骤为:
步骤1:准确称量一个洁净、干燥的坩埚;
步骤2:将一定量的硫酸铜晶体试样研细后,放入坩埚中称重
步骤3:将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
步骤4:将步骤3中的坩埚放入干燥器,冷却至室温后,称重:
步骤5: ▲ ;
步骤6:根据实验数据计算硫酸铜晶体试样中结晶水的质量分数。
请完成实验步骤5。
(3)已知硫酸铜晶体受热可以逐步失去结晶水,温度升高还可以分解生成铜的氧化物。取25.0gCuSO4·5H2O晶体均匀受热,缓慢升温至1200℃并恒温1小时,实验测得固体残留率(剩余固体的质量/原始固体质量)与温度的关系如下图所示:
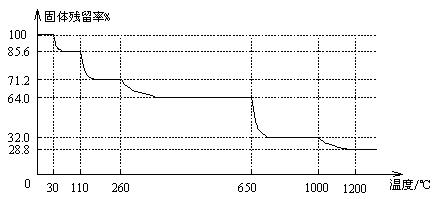
在110℃时所得固体的成分为 ▲ ;在1200℃并恒温1小时,反应所得气态产物除去水后,物质的量为 ▲ 。(填字母)
A.0mol B.0.1mol C.0.125mol D.大于0.125mol
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
(1)工业上二氧化钛的制备是: 资料卡片:
物质熔点SiCl4-70 ℃ 、 TiCl4 -25 ℃;物质沸点SiCl457.6 ℃、TiCl4136.5℃
Ⅰ.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4。
Ⅱ.将SiCl4分离,得到纯净的TiCl4。
Ⅲ.在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
Ⅳ.经过滤、水洗除去其中的Cl—,再烘干、焙烧除去水分得到粉体TiO2 。
①在常温下分离TiCl4与SiCl4所采取的操作名称是 ;
②Ⅲ中反应的化学方程式是 ;
③ 检验TiO2·xH2O中Cl-是否被除净的方法是______________________________。
(2)TiO2粒子的大小可以用现代分析仪器测定,而用氧化还原滴定法可测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+ ,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。回答下列问题:
①下列可用于测定TiO2粒子大小的方法是_____________________(填字母代号)。
a.核磁共振法 b.红外光谱法 c.质谱法 d.透射电子显微镜法
②配制NH4Fe(SO4)2标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的_____(填字母代号)。
③滴定终点的现象是___________________________________________________。
④滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为_________________________。
⑤若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,对TiO2质量分数测定结果的影响_________________________。(填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(14分)能源开发、环境保护、资源利用等是当今社会的热门话题。请根据所学化学知识回答下列问题:
(1)汽车上安装催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:N2(g) + O2(g)=2NO(g) △H=+180.5 kJ · mol-1;
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ ·mol-1;
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ ·mol-1
则尾气转化反应2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=________________。
(2)汽车尾气分析仪对CO的含量分析是以燃料电池为工作原理,其装置如下图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质中自由移动。

下列说法中正确的是_____________(填字母序号)。
A.负极的电极反应式为:CO + O2-―2e-=CO2
B.工作时电子由电极a通过传感器流向电极b
C.工作时电极b作正极,O2-由电极a通过固体介质向电极b迁移
D.传感器中通过的电流越大,尾气中CO的含量越高
(3)某硝酸厂利用甲醇处理废水。在一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比为______________。
(4)煤的间接液化是先转化为CO和H2,再在催化剂作用下合成甲醇。若在一定温度下,向1 L密闭容器中加入CO和H2,发生反应CO(g)+2H2(g) CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:
| 物 质 | CO | H2 | CH3OH |
| 浓度/(mol·L-1) | 1.2 | 1.0 | 0.6 |
① 该反应的平衡常数表达式为:K=_____________________。
② 该时间内反应速率v(H2)=_________________。
③ 平衡时CO的转化率为_________________(保留1位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com