
| A.大多数化学反应在一定条件下都有一定的限度 |
| B.依据焓判据:NH4HCO3受热分解可自发进行 |
| C.使用催化剂,既能加快反应速率,又能改变反应限度 |
| D.平衡常数K的大小能说明反应的限度,因此当平衡右移时,K值必定增大 |
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.能够发生化学反应的碰撞是有效碰撞 | B.反应物分子的每次碰撞都能发生化学反应 |
| C.活化分子之间的碰撞一定是有效碰撞 | D.增大反应物浓度时,活化分子百分数增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.石墨比金刚石稳定 | B.石墨总能量比等质量的金刚石高 |
| C.该变化属于物理变化 | D.该反应的焓变△H<0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知: ====
==== △H=+64kJ/mol
△H=+64kJ/mol ====
==== △H= -196kJ/mol
△H= -196kJ/mol ="==="
="==="  △H= -286kJ/mol
△H= -286kJ/mol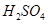 溶液中
溶液中 与
与 反应生成
反应生成 和
和 的热化学方程式为 。
的热化学方程式为 。 和3.0 mol/L的
和3.0 mol/L的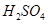 混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。| | 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| | 铜平均溶解速率 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
| | ( ) ) | | | | | | | |
 溶液中加入一定量的
溶液中加入一定量的 和
和 溶液,加热,生成
溶液,加热,生成 沉淀。制备
沉淀。制备 的离子方程式是 。
的离子方程式是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH3OH(l)+O2(g)===CO2(g)+2H2O(l)ΔH=+725.8 kJ/mol |
| B.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)ΔH=-1 452 kJ/mol |
| C.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)ΔH=-725.8 kJ/mol |
| D.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)ΔH=+1 452 kJ?mol?1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.由F原子形成1molF—F键要吸收热量 |
| B.所有燃烧反应都要有氧气参与且都是放热反应 |
| C.酸碱之间的中和反应都是放热反应 |
| D.吸热反应必须加热才能进行 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 键分别需要的能是436kJ、39lkJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________。
键分别需要的能是436kJ、39lkJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com