
现有一定温度下的2L密闭容器中存在如下反应:
2SO2+O2 ![]() 2SO3,
2SO3,
向密闭容器中通入4mol SO2和2molO2,当SO2的转化率为80%时,反应达到平衡状态。
(1)求反应的平衡常数.
(2)若平衡保持体积不变,充入稀有气体Ar使压强增大为原来的3倍,反应将向哪方向进行?
(3)若平衡后混合物的压强减小一倍,体积变为原来的两倍,反应将向哪方向进行?计算说明。
科目:高中化学 来源: 题型:阅读理解
| 光 |
| Cu2O |
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器甲、丙中,逆反应的速率:v(甲)=v(丙) | B、容器甲、乙中,HI 的物质的量:n(甲)<n(乙) | C、容器甲、乙中有关反应物的转化率:α(H2)+α(HI)<100% | D、容器甲、乙中,化学平衡常数:K(甲)=K(乙) |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年云南省昆明三中、滇池中学高二下学期期末考试化学卷(带解析) 题型:填空题
(1)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。
①pH增大能加速O3分解,表明对O3分解起催化作用的是_________________。
②据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________(填代号)
a. 40°C、pH=3.0 b. 10°C、pH=4.0 c. 30°C、pH=7.0
(2)向一容积为2升的密闭容器中充入2molA、0.6molC和一定量的B三种气体,一定条件下发生某种反应。现有两个图像分别对该反应的情况进行描述:
图1表示各物质的浓度随时间的变化情况,其中t0~t1阶段c(B)未画出;
图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件(其中t2改变的条件是加入某种催化剂);(说明:图1中实线表示反应进程)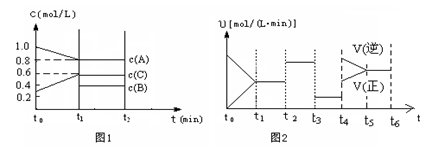
①你认为t3时改变的条件是 (填写“加压”或“减压”),B的起始物质的量为 mol;
②各阶段平衡时对应的平衡常数如下表所示:
| 时间段 | t1~t2 | t2~t3 | t3~t4 | t5~t6 |
| 平衡常数 | K1 | K2 | K3 | K4 |
 CH3OH(g)反应合成甲醇。
CH3OH(g)反应合成甲醇。| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |

查看答案和解析>>
科目:高中化学 来源:2014届云南省高二下学期期末考试化学卷(解析版) 题型:填空题
(1)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。

①pH增大能加速O3分解,表明对O3分解起催化作用的是_________________。
②据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________(填代号)
a. 40°C、pH=3.0 b. 10°C、pH=4.0 c. 30°C、pH=7.0
(2)向一容积为2升的密闭容器中充入2molA、0.6molC和一定量的B三种气体,一定条件下发生某种反应。现有两个图像分别对该反应的情况进行描述:
图1表示各物质的浓度随时间的变化情况,其中t0~t1阶段c(B)未画出;
图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件(其中t2改变的条件是加入某种催化剂);(说明:图1中实线表示反应进程)

①你认为t3时改变的条件是 (填写“加压”或“减压”),B的起始物质的量为 mol;
②各阶段平衡时对应的平衡常数如下表所示:
|
时间段 |
t1~t2 |
t2~t3 |
t3~t4 |
t5~t6 |
|
平衡常数 |
K1 |
K2 |
K3 |
K4 |
用“﹥、﹤、=”符号来表达K1、K2、K3、K4之间的关系 写此条件下该反应的热化学方程式 ________________
(3)工业上一般采用CO(g) + 2H2(g)  CH3OH(g)反应合成甲醇。
CH3OH(g)反应合成甲醇。
下表所列数据是该反应在不同温度下的化学平衡常数的数值:
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
①某温度下,将1mol CO和4mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)= 0.1 mol/L,则CO的转化率为 ,此时的温度 250℃(填“>”、“<”、“=”)
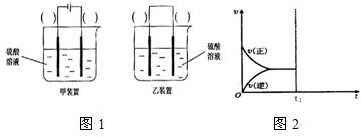
②如下图是甲醇燃料电池(电解质溶液为KOH溶液)的结示意图,则a处通入的是
(填“甲醇”或“氧气”),b处电极上发生的电极反应是: 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com