
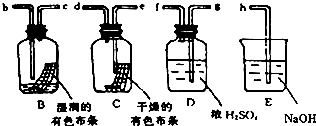
分析 (1)其连接顺序是:反应装置→洗气装置→干燥装置→检验装置→尾气处理装置;
(2)干燥的氯气不能使干燥的有色布条褪色,但能使湿润的有色布条褪色,氯气和水反应生成HCl和HClO;
(3)Cl2与H2O反应生成HClO,反应的化学方程式为Cl2+H2O=HCl+HClO,具有漂白性的物质为HClO,如确证,可检验盐酸是否能使红布条褪色;
(4)氯气和NaO反应生成氯化钠、次氯酸钠和水;
(5)氯气和氢氧化钙反应生成而制备漂白粉;漂白粉中含有Ca(ClO)2,易与空气中的水和二氧化碳反应生成不稳定的HClO而变质.
解答 解:(1)其连接顺序是:反应装置→洗气装置→干燥装置→检验装置→尾气处理装置,所以本题实验B和C是检验装置、D是干燥装置、E是尾气处理装置,所以其连接顺序是Cl2接g,f接e,d接b,c接h,故答案为:g;f;e;d;b;c;h;
(2)B中没有水,C中有水,氯气溶于水得到氯水,B中有色布条褪色、C中有色布条褪色,说明干燥的Cl2没有漂白性,氯水有漂白性;氯气和水反应方程式为Cl2+H2O?HCl+HClO,故答案为:干燥的Cl2没有漂白性,氯水有漂白性;Cl2+H2O?HCl+HClO;
(3)Cl2+H2O?HCl+HClO,所以需要设计一个实验在一个红色布条上滴加盐酸,布条无变化,排除氯化氢的漂白性,就证明起漂白作用的物质是次氯酸,
故答案为:盐酸是否能使红布条褪色;
(4)氯气和NaO反应生成氯化钠、次氯酸钠和水,反应方程式为Cl2+2NaOH═NaCl+NaClO+H2O,故答案为:Cl2+2NaOH═NaCl+NaClO+H2O;
(5)氯气和氢氧化钙反应生成而制备漂白粉,反应方程式为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;漂白粉中含有Ca(ClO)2,易与空气中的水和二氧化碳反应生成不稳定的HClO而变质,方程式为Ca(ClO)2+2H2O+2CO2=Ca(HCO3)2+2HClO,HClO不稳定,见光分解,方程式为2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;Ca(ClO)2+2H2O+2CO2=Ca(HCO3)2+2HClO,2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑.
点评 本题考查HClO的漂白性的探究,题目难度不大,本题注意氯气与次氯酸性质的差异性,注意有关反应化学方程式或者离子方程式的书写,把握反应的原理.


科目:高中化学 来源: 题型:多选题
| A. | 1mol/L | B. | 1.5mol/L | C. | 3mol/L | D. | 7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)工业上可利用CO2和H2生产甲醇,方程式如下:
(1)工业上可利用CO2和H2生产甲醇,方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼热的炭与二氧化碳反应 | B. | 铁和稀硫酸的反应 | ||
| C. | 氢氧化钡晶体的粉末和稀硫酸混合 | D. | 木炭在氧气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用燃烧的方法鉴别真丝围巾和纯棉围巾 | |
| B. | 在烹调中加料酒和食醋,增加食物的香味 | |
| C. | 用工业酒精兑制饮用酒出售来提高利润 | |
| D. | 食用加碘盐,预防因缺碘引起的甲状腺肿大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
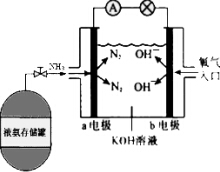 氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力.氨氧燃料电池示意图,回答下列问题.
氨作为一种富氢化合物,具有各种优点,特别是氨有着良好的产业基础,价格低廉,氨作为燃料电池燃料具有很大的发展潜力.氨氧燃料电池示意图,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 制备Fe(OH)3胶体:向0.1mol•L-1FeCl3溶液中加入等体积0.3mol•L-1NaOH溶液 | |
| B. | 除去FeCl3溶液中少量Cu2+:向含有少量Cu2+的FeCl3溶液中加入适量铁粉至蓝色刚好消失后过滤 | |
| C. | 等浓度的碳酸钠溶液和硫酸钠溶液,前者碱性强,可以证明硫的非金属性比碳强 | |
| D. | 验证氧化性Fe3+<Br2<Cl2:向试管中依次加入1mL 0.1mol•L-1FBr2溶液、几滴KSCN 溶液和1mL苯,然后逐滴加入氯水,并缓缓振荡,直到氯水过量,观察整个过程中有机相和水相中的现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com