

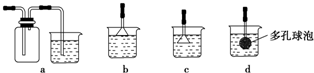
分析 由实验流程可知,加足量的NaOH生成氢氧化镁沉淀,溶液a中含AlO2-、K+、Cl-、Na+、OH-,然后加盐酸,沉淀c为氢氧化铝,和盐酸反应生成氯化铝,溶液b中含KCl、NaCl,以此来解答.
(1)①镁离子\和氢氧化钠反应生成氢氧化镁沉淀,铝离子和足量的氢氧化钠反应先生成氢氧化铝沉淀,生成的氢氧化铝沉淀溶解于过量氢氧化钠溶液生成偏铝酸钠和水,据此书写离子方程式;
②根据发生的反应判断a溶液中存在离子,由于氢氧化铝为两性氢氧化物,能溶于强酸,故最佳方案是通入二氧化碳气体,氢氧化铝不溶于二氧化碳溶液中;
(2)在知道混合物质量的前提下,方案I可以使用碱液,此时气体是由铝生成的,由此可求出铝的量;也可以使用酸液,此时气体是由镁铝共同生成,根据混合物的质量、生成气体的体积分别列一个方程,联立即可计算镁铝的量;但方案II中由于是根据剩余固体的质量来解题,所以只能用碱液;再结合具体的实验操作来解本题,镁和铝都均可以与稀硝酸反应,最后没有固体剩余.
解答 解:由实验流程可知,加足量的NaOH生成氢氧化镁沉淀,过滤得到溶液a中含AlO2-、K+、Cl-、Na+、OH-,然后加盐酸,沉淀c为氢氧化铝,加盐酸生成氯化铝,溶液b中含KCl、NaCl;
(1)①混合物中镁离子和铝离子和氢氧化钠反应,镁离子生成氢氧化镁沉淀,反应的离子方程式为:Mg2++2OH-=Mg(OH)2↓,铝离子和足量的氢氧化钠反应先生成氢氧化铝沉淀,离子方程式为:Al3++3OH-═Al(OH)3↓,生成的氢氧化铝沉淀溶解于过量氢氧化钠溶液生成偏铝酸钠和水,铝离子和足量的氢氧化钠反应生成偏铝酸钠和水,反应的离子方程式为:Al3++4OH-=2H2O+AlO2-,
故答案为:Mg2++2OH-=Mg(OH)2↓,Al3++4OH-=2H2O+AlO2-或Mg2++2OH-═Mg(OH)2↓ Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O;
②Al3+与过量NaOH反应,溶液a中含AlO2-、K+、Cl-、Na+、OH-,阴离子为:AlO2-、Cl-、OH-,向溶液a中加入盐酸,生成氢氧化铝沉淀,因氢氧化铝能溶于盐酸,则向溶液a中滴加盐酸需控制溶液的pH,向溶液a中加入试剂X的最佳方案是通入过量的二氧化碳生成氢氧化铝沉淀和碳酸氢钠,过滤得到氢氧化铝固体,反应的离子方程式为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,
故答案为:AlO2-、Cl-、OH-;因为氢氧化铝能与强酸反应,所以在加入盐酸沉淀AlO2-时,需要控制溶液的pH,以防止部分氢氧化铝转化成Al3+;通入过量的二氧化碳;
(2)A、在方案I中,能与NaOH溶液反应的只有铝,根据生成的氢气可以计算出混合物中铝的质量,从而能计算出镁的质量及镁在混合物中的质量分数,故溶液A可为NaOH溶液;在方案II中,镁与NaOH溶液不反应,铝与NaOH溶液反应,剩余的固体为镁,可以计算出镁的质量分数,故A正确;
B、若溶液B选用浓硝酸,铝在浓硝酸中生成一层致密的氧化物保护膜,发生钝化现象,剩余固体的质量大于混合物中铝的质量,实际测量镁的质量减少,镁的含量降低固体则测得镁的质量分数偏小,故B正确;
C、镁和铝都均可以与稀硝酸反应,利用测量气体的体积,可以计算出混合物中镁、铝的质量,反应最后没有固体剩余,不能通过测量剩余固体的质量进行,故C错误;
D、测量气体的体积不如测量固体的质量简单易操作,故D正确;
故选:C.
点评 本题考查混合物分离、提纯实验方案的设计,为高频考点,把握实验流程中发生的反应为解答的关键,侧重分析与实验能力的考查,注意氢氧化铝的两性,清楚物质的性质、理解实验方案原理是关键,题目难度中等.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:选择题
| A. | 向Fe(OH)2中加入足量的稀HNO3:3Fe(OH)2+10H++NO3-═3Fe3++NO↑+6H2O | |
| B. | 在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:3ClO+4OH-+2Fe(OH)3═3Cl-+5H2O+2FeO42- | |
| C. | 电解质溶液能够导电,是因为在通电时电解质电离产生了自由移动的离子 | |
| D. | a gC2H4和C3H6的混合物燃烧时消耗的O2一定是33.6a/14 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
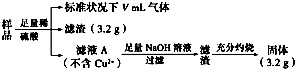
| A. | V=44.8 | |
| B. | 原样品中Fe元素的质量分数为38.89% | |
| C. | 滤液A中的阳离子为Fe2+、Fe3+、H+ | |
| D. | 样品中CuO的质量为4.0 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol NH2- 含有9 NA个电子 | |
| B. | 1.8 g的NH4+离子中含有的电子总数为NA | |
| C. | 0℃时,44.8L SO3含有的氧原子数为6 NA | |
| D. | 2.4 g金属镁变为镁离子时失去的电子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、
、 、
、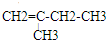 、
、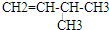 .
.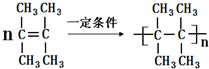 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | C2H5OH浓硫酸170℃共热, 制得气体通入酸性KmnO4溶液 | 检验制得气体是否为乙烯 |
| B | 向含有少量的FeBr2和FeCl2溶液中 加入适量氯水,再加CCl4萃取分液 | 除去FeCl2溶液中的FeBr2 |
| C | 在淀粉溶液中滴加少量市售食盐配制的溶液 | 鉴别真假碘盐 |
| D | 银氨溶液中滴入少量组成为C2H4O2的液态 有机物,水溶微热,有银镜出现 | 不能确定该有机物一定是甲酸甲酯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 适当升高温度 | B. | 将锌粒改为锌粉 | ||
| C. | 将所用硫酸加适量水适当稀释 | D. | 寻找一种合适的催化剂并加入其中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com