
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A. | 原子半径:丙<丁<戊 | |
| B. | 金属性:甲>乙 | |
| C. | 最外层电子数:甲>乙 | |
| D. | 最高价氧化物的水化物的碱性:丙>丁>戊 |
分析 由短周期金属元素甲~戊在元素周期表中的相对位置可知,甲为Li,乙为Be,丙为Na,丁为Mg,戊为Al,
A.同周期从左向右原子半径减小;
B.同周期从左向右金属性减弱;
C.同周期从左向右最外层电子数增多;
D.同周期从左向右金属性减弱,金属性越强,对应最高价氧化物的水化物的碱性越强.
解答 解:A.同周期从左向右原子半径减小,则原子半径:丙>丁>戊,故A错误;
B.同周期从左向右金属性减弱,则金属性:甲>乙,故B正确;
C.同周期从左向右最外层电子数增多,则最外层电子数:甲<乙,故C错误;
D.金属性丙>丁>戊,对应最高价氧化物的水化物的碱性为丙>丁>戊,故D正确;
故选BD.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 200 mL 1 mol•L-1 KCl溶液 | B. | 50 mL 2 mol•L-1CaCl2溶液 | ||
| C. | 150 mL 2 mol•L-1 NaCl溶液 | D. | 50 mL 1 mol•L-1AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
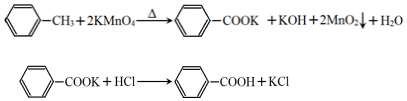
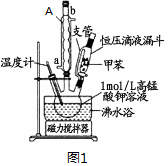
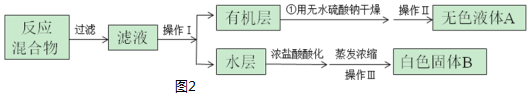
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在由水电离产生的氢离子浓度为10-13 mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3-四种离子能大量共存 | |
| B. | 已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)=6.82×10-6 | |
| C. | 常温下,将0.2 mol?L-1某一元碱(ROH)溶液和0.1 mol?L-1HCl溶液等体积混合,混合后溶液pH<7,则c(ROH)>c(R+) | |
| D. | 对于反应N2H4(l)=N2(g)+2H2(g),△H=-50.6 kJ?mol-1,它只在高温下自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com