
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:阅读理解
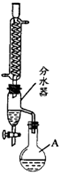 (2012?江苏三模)乙酸正丁酯是常用的食用香精.实验室用正丁醇和乙酸制备乙酸正丁酯的装置如图所示(加热、搅拌和仪器固定装置均已略去),实验过程如下:
(2012?江苏三模)乙酸正丁酯是常用的食用香精.实验室用正丁醇和乙酸制备乙酸正丁酯的装置如图所示(加热、搅拌和仪器固定装置均已略去),实验过程如下:查看答案和解析>>
科目:高中化学 来源: 题型:

| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
查看答案和解析>>
科目:高中化学 来源:2013届新课标高三配套月考(四)化学试卷(B卷)(带解析) 题型:实验题
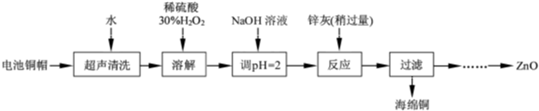
[2012·江苏卷] (14分)废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn总含量约为99%)回收 Cu并制备ZnO的部分实验过程如下: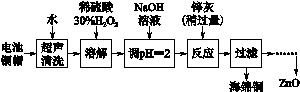
(2)①铜帽溶解时加入H2O2的目的是______ _____________________(用化学方程式表示)。
②铜帽溶解完全后,需将溶液中过量的H2O2除去。除去H2O2的简便方法____ ___。
(3)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:
2Cu2++4I-===2CuI(白色)↓+I2
2S2O32-+I2===2I-+S4O62-
①滴定选用的指示剂为________,滴定终点观察到的现象____________________。
②若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会________(填“偏高”、“偏低”或“ 不变”)。
已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com