
Na2S2O3·5H2O可作为高效脱氯剂,工业上用硫铁矿(FeS2)为原料制备该物质的流程如下。

已知:I.气体A可以使品红溶液褪色,与硫化氢(H2S)混合能获得单质硫。
II.pH约为11的条件下,单质硫与亚硫酸盐可以共热生成硫代硫酸盐。
回答下列问题:
(1)沸腾炉中将粉碎的硫铁矿用空气吹动使之达到“沸腾”状态,其目的是 。(2)吸收塔中的原料B可以选用 (填字母序号)。
a.NaCl溶液 b.Na2CO3溶液 c.Na2SO4溶液
(3)某小组同学用下图装置模拟制备Na2S2O3 的过程(加热装置已略去)。
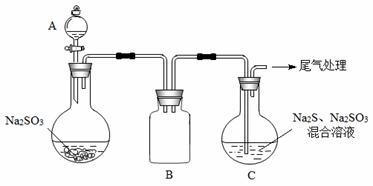
① A中使用70%的硫酸比用98%的浓硫酸反应速率快,其原因是 。装置B的作用是 。
② C中制备Na2S2O3发生的连续反应有:Na2S + H2O + SO2 ===Na2SO3 +H2S、
和 。
(4)工程师设计了从硫铁矿获得单质硫的工艺,将粉碎的硫铁矿用过量的稀盐酸浸取,得到单质硫和硫化氢气体,该反应的化学方程式为 。
科目:高中化学 来源: 题型:
甲、乙、丙都是短周期元素,其中甲、乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M层电子数之和与L层的电子数相同。下列判断不正确的是( )
A.乙元素的族序数比甲元素的族序数大
B.甲、丙两元素最高价氧化物对应水化物的酸性强弱:甲<丙
C.原子半径的大小:甲>乙
D.含乙元素的化合物数目比含甲或丙元素的化合物数目多
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是某同学设计的原电池装置,下列叙述中正确的是( )

|
| A. | 电极Ⅰ上发生还原反应,作原电池的负极 |
|
| B. | 电极Ⅱ的电极反应式为:Cu2++2e﹣=Cu |
|
| C. | 该原电池的总反应为:2Fe3++Cu=Cu2++2Fe2+ |
|
| D. | 盐桥中装有含氯化钾的琼脂,其作用是传递电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于0.1 mol·L-1 NaHCO3溶液,下列说法正确的是
A.溶质水解反应:HCO3- +H2O H3O++CO32-
H3O++CO32-
B.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
C.微粒浓度关系:c(Na+)>c(HCO3-) >c(H2CO3)>c(CO32-)
D.微粒浓度关系:c(Na+)=2[c(H2CO3)+c(HCO3-)+c(CO32-)]
查看答案和解析>>
科目:高中化学 来源: 题型:
下述实验方案能达到实验目的的是
| 编号 | A | B | C | D |
| 实验 方案 |
|
|
|
|
| 实验 目的 | 实验室制备乙酸乙酯 | 分离乙酸和水 | 验证溴乙烷在氢氧化钠乙醇溶液中发生消去反应产生的乙烯 | 收集乙烯并验证它与溴水发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学反应的自发性叙述中正确的是
A.焓变小于0而熵变大于0的反应肯定是自发的
B.焓变和熵变都小于0的反应肯定是自发的
C.焓变和熵变都大于0的反应肯定是自发的
D.熵变小于0而焓变大于0的反应肯定是自发的
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两个容器内都进行A→B的反应,甲容器内每分钟减少了4mol A,乙容器内每分钟减少2mol A,则甲容器内的反应速率比乙容器内的反应速率
A.快 B.慢 C.相等 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验药品:铜、铁、镁、0.5mol/LH2SO4、2mol/LH2SO4、、18.4mol/LH2SO4
【I】甲同学研究的实验报告如下表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中 ②分别投入大小、形状相同的铜、铁、镁 | 反应速率镁>铁,铜不反应 | 金属的性质越活泼,反应速率越快 |
(1)甲同学的实验目的是 ;要得出正确的实验结论,还需控制的实验条件是 。
【II】乙同学为了更精确的研究浓度对反应速率的影响,利用下图所示装置进行实验。
(2)乙同学在实验中应该测定的数据是 。
(3)乙同学完成该实验应选用的实验药品 。不选用某浓度的硫酸,理由是 。
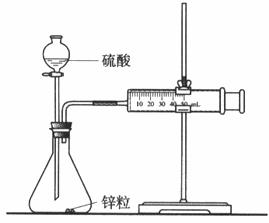
测量锌与硫酸反应速率的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验事实可以用同一反应原理解释的是( )
A.活性炭、氯气都能使品红溶液退色
B.乙酸、葡萄糖都能与新制Cu(OH)2悬浊液反应
C.乙烯、氯乙烯都能使溴水退色
D.淀粉、蛋白质都能发生显色(或颜色)反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com