
C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用.请回答下列问题:
(1)32号元素Ge的原子核外电子排布式为 ;
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是 ;
(3)已知SnO2是离子晶体,写出其主要物理性质 ;(写出2条即可)
(4)已知:
| CH4 | SiH4 | NH3 | PH3 |
沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
分解温度(K) | 873 | 773 | 1073 | 713.2 |
分析上表中四种物质的相关数据,请回答:
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是 ;
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是 ;
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时 ;
(5))用价层电子对互斥理论推断SnBr2分子中Sn—Br的键角 120°(填“>”“<”或“=”)。
(6)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为 ,每个Ba2+与 个O2-配位。
(1)[Ar]3d104s24p2
(2)Sn
(3)熔沸点较高,硬度较大
(4)①CH4和SiH4比较,相对分子质量越大,范德华力越大,故沸点高,而NH3和PH3比较前者分子间存在氢键沸点高
②分解破坏的均为共价键,C-H的键能大于Si-H的键能,N-H键的键能大于P-H键的键能;HF。
(5)<
(6)PbBaO3 12
【解析】(1)Ge的原子序数为32,则电子排布式为[Ar]3d104s24p2,故答案为:[Ar]3d104s24p2;
(2)C、Si、Sn随原子序数增大,非金属性减弱,金属性增强,只有Sn为金属,则Sn为金属晶体,故答案为:Sn;
(3)离子晶体熔沸点较高,硬度较大,熔融状态能导电等性质,故答案为:熔沸点较高,硬度较大;
(4)①CH4和SiH4比较,相对分子质量大的沸点高,而NH3和PH3比较,氨气中含有氢键沸点大,
故答案为:CH4和SiH4比较,相对分子质量越大,范德华力越大,故沸点高,而NH3和PH3比较前者分子间存在氢键沸点高;
②由键长越短,键能越大,越稳定,分解温度就越高可知,分解破坏的均为共价键,C-H的键能大于Si-H的键能,N-H键的键能大于P-H键的键能,
故答案为:分解破坏的均为共价键,C-H的键能大于Si-H的键能,N-H键的键能大于P-H键的键能;
一定压强下,沸点高的气体先液化,HF分子之间存在氢键,沸点高,则HF和HCl的混合气体降温时HF先液化,
故答案为:HF。
(5)SnBr2分子中,Sn原子的价层电子对数目是(4+2)/2=3,配位原子数为2,故Sn含有孤对电子,SnBr2空间构型为V型,键角小于120°。
(6)根据均摊法可知,每个晶胞含有Pb4+:8×1/8=1个,Ba2+:1个,O2-:12×1/4
=3个,故化学式为PbBaO3,Ba2+ 处于晶胞中心,只有一个,O2-处于晶胞棱边中心,共有12个,故每个Ba2+与12个O2-配位。


科目:高中化学 来源:2014高考名师推荐化学CB计算法(解析版) 题型:选择题
在80 g密度为d g·cm-3的硫酸铁溶液中,含有2.8 g Fe3+,则此溶液中SO42-的物质的量浓度(mol·L-1)为
A.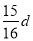 B.
B.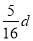 C.
C.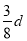 D.
D.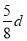
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:选择题
用表示阿伏加德罗常数的数值,下列说法正确的是
A.1 mol Na2O2晶体中共含有个离子
B.0.1 molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒
C.常温常压下,和混合气体含有个氧原子
D.电解法冶炼铝时每转移个电子,阳极生成氧气
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测6 题型:选择题
辨析以下的说法①l6O与 l8O的转化可以通过化学反应实现;②灼烧钠的化合物时火焰呈黄色,那是发生了化学反应;③碱性氧化物一定是金属氧化物;④只由一种元素组成的物质一定是纯净物;⑤石墨与金刚石的转化是化学变化;⑥糖类、蛋白质、油脂均属于天然高分子化合物;上述说法中正确的是
A.①④⑤
B.①②④
C.③⑤
D.①③⑥
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测5 题型:简答题
2013年1月13日中国应用技术网报道了利用苯制备偶氮染料和医药中间体的方法,下面是制备偶氮染料F和医药中间体Y的流程图如下:
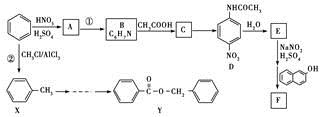
回答下列问题:
(1)苯的核磁共振氢谱中有________峰,反应①的反应类型____________;
(2)写出D→E反应的化学方程式______________________。
(3)写出化合物A、F的结构简式。A____________、F____________。
(4)设计A→D的目的是______________________。
(5)写出满足下列条件的C的任意两种同分异构体的结构简式________。
a.是苯的对位二取代产物;b.能发生银镜反应
(6)参照上述流程图设计从X到Y的合成路线。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测5 题型:选择题
将右图所示实验装置的K闭合,下列判断正确的是
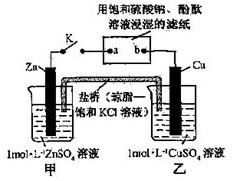
A.Zn电极上发生还原反应
B.片刻后盐桥中的Cl-向乙装置中移动
C.片刻后在a点滴加酚酞观察到滤纸变红色
D.片刻后在b点滴加淀粉碘化钾溶液观察到滤纸无变化
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测5 题型:选择题
现有等物质的量的铜和银的混合物17.2克,与50.0mL的浓硝酸恰好完全反应,产生气体4.48L(标准状况),则下列说法正确的是
A.产生的气体是0.2molNO2
B.硝酸的物质的量浓度为12mol/L
C.反应中被还原和未被还原的硝酸物质的量之比为3:2
D.要使产生的气体恰好完全被水吸收需要通入氧气0.075mol
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:选择题
下列实验正确且能达到目的是
A.溴水中存在着如下的平衡:Br2+H2O HBr+HBrO,若要使溴水的颜色变浅,可采取的措施是加入NaI晶体
HBr+HBrO,若要使溴水的颜色变浅,可采取的措施是加入NaI晶体
B.在温水瓶中加入Na2CO3溶液泡浸后加入盐酸能除去内壁CaSO4
C.用饱和的NaOH热溶液除去乙酸乙酯中的乙醇、乙酸
D.亚硫酸钠具有较强的还原性,检验亚硫酸钠试样是否变质:

查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测17 题型:推断题
甲酯除草醚(下图中E)是一种光合作用抑制剂,能被叶片吸收,但在植物体内传导速度较慢,它是芽前除草剂,主要用于大豆除草。某烃A合成E的路线如下:A
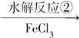
 B
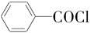
B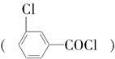

C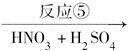 D
D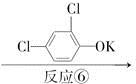

(1)写出A、C的结构简式:A________;C________。
(2)写出C中官能团的名称:________________。
(3)写出下列反应的化学方程式:
反应⑤______________________________________________________;
反应⑥__________________________________________________________,
反应类型是____________________________________________________。
(4)C的同分异构体有多种。写出核磁共振氢谱有四种不同化学环境的氢,且峰面积比为1∶2∶2∶2的四种有机物的结构简式: _________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com