
N2(g)+3H2(g)
 2NH3(g) ΔH<0的平衡体系中,当分离出NH3时,下列说法正确的是( )
2NH3(g) ΔH<0的平衡体系中,当分离出NH3时,下列说法正确的是( )
A.改变条件后速率—时间图象如右图: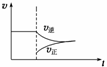
B.此过程中Q>K
C.平衡体系中NH3的含量增大
D.N2的转化率增大
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
某温度下,在体积为2 L的密闭容器中充入1 mol A和b mol B气体,发生如下反应:A(g)+B(g)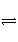
 2C(g),5 min后反应达平衡时n(A)为0.4 mol。在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度的关系如下图所示。下列叙述正确的是( )
2C(g),5 min后反应达平衡时n(A)为0.4 mol。在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度的关系如下图所示。下列叙述正确的是( )
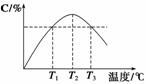
A.0~5 min,C物质的平均反应速率为0.04 mol·L-1·min-1
B.图中温度T1时的正反应速率等于温度T3时的正反应速率
C.该反应温度T2时的平衡常数大于温度T3时的平衡常数
D.图中T2时,若只增大压强,则正、逆反应速率不改变
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关合成氨工业的叙述,可用勒·夏特列原理来解释的是( )
A.使用铁触媒,使N2和H2混合气体有利于合成氨
B.高压比常压条件更有利于合成氨的反应
C.500℃左右比室温更有利于合成氨的反应
D.合成氨时采用循环操作,可提高原料的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积相同的密闭容器中,分别充入等量的氮气和氢气,在不同温度下发生反应:N2(g)+3H2(g)
 2NH3(g),并分别在不同的时间内测定其中NH3的质量分数(y轴所表示的),绘成图象如图所示,请回答:
2NH3(g),并分别在不同的时间内测定其中NH3的质量分数(y轴所表示的),绘成图象如图所示,请回答:
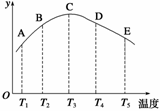
(1)A、B、C、D、E五点中,肯定未达平衡的点是
________________________________________________________________________。
(2)此可逆反应的正反应是__________热反应。
(3)AC曲线是增函数曲线,CE曲线是减函数曲线,试从化学反应速率和化学平衡的角度分析,并说明理由
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验原理或实验操作正确的是( )
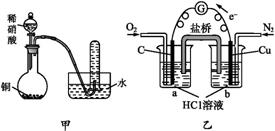
A.用甲装置验证铜与稀硝酸的反应产物是NO
B.通过乙装置实现化学反应:2Cu+O2+4H+ 2Cu2++2H2O
2Cu2++2H2O
C.用适量铜粉除去CuCl2溶液中少量的FeCl3
D.在乙酸乙酯样品中加入适量的乙醇加热,可除去其中混有的少量乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
某混合物甲中含有明矾[KAl(SO4)2]、Al2O3和Fe2O3.在一定条件下由甲可实现如图所示的物质之间的转化:
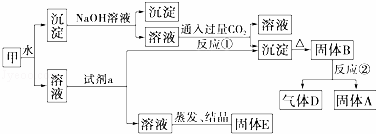
请回答下列问题:
(1)写出A、B、D的化学式:A、B、D.
(2)试剂a最好选用D(选填A、B、C、D).
A.NaOH溶液 B.稀盐酸 C.二氧化碳 D.氨水
(3)写出反应①的离子方程式:﹣.
(4)固体E可以作为复合性的化学肥料,E中所含物质的化学式为.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com