
【题目】已知下列热化学方程式:①H2(g)+![]() O2(g)=H2O(l)ΔH=-285.8kJ/mol②H2(g)+
O2(g)=H2O(l)ΔH=-285.8kJ/mol②H2(g)+![]() O2(g)=H2O(g)ΔH=-241.8kJ/mol③C(s)+
O2(g)=H2O(g)ΔH=-241.8kJ/mol③C(s)+ ![]() O2(g)=CO(g)ΔH=―110.4 kJ/mol④C(s)+O2(g)=CO2(g)ΔH=-393.5kJ/mol。回答下列各问:
O2(g)=CO(g)ΔH=―110.4 kJ/mol④C(s)+O2(g)=CO2(g)ΔH=-393.5kJ/mol。回答下列各问:
(1)上述反应中属于放热反应的是_______。(填序号)
(2)H2的燃烧热为___;C的燃烧热为____。
(3)燃烧4g H2生成液态水,放出的热量为_______。
(4)根据盖斯定律可知CO的燃烧热为_____;其热化学方程式为_____。
(5)比较下列各组热化学方程式中△H的大小:
①C(s)+O2(g)=CO2(g)△H1 C(s)+![]() O2(g)=CO(g) △H2 △H1 ____△H2
O2(g)=CO(g) △H2 △H1 ____△H2
②S(s)+O2(g)=SO2(g)△H3 S(g)+O2(g)=SO2(g) △H4 △H3 __△H4
【答案】①②③④ 285.8kJ/mol 393.5kJ/mol 571.6kJ 110.5 kJ/mol CO(g)+ ![]() O2(g)=CO2(g) Δ H=-110.5 kJ/mol < >
O2(g)=CO2(g) Δ H=-110.5 kJ/mol < >
【解析】
(1)根据放热反应的焓变为负值分析。
(2)根据燃烧热指1mol可燃物完全燃烧生成稳定的氧化物时放出的热量。注意稳定的氧化物,液态水稳定。碳完全燃烧生成二氧化碳。
(3)根据物质的量与热量成正比关系分析。
(4)根据反应热只与反应的始态和终态有关分析。
(5)根据完全燃烧放热多,但焓变为负值分析大小。根据物质的气态具有的能量高于固体的能量分析。
(1)放热反应的焓变为负值分析,所以四个反应都为放热反应。
(2)根据燃烧热指1mol可燃物完全燃烧生成稳定的氧化物时放出的热量,氢气的燃烧热为285.8kJ/mol;C的燃烧热为393.5kJ/mol。
(3)根据氢气的燃烧热分析,4克氢气反应放出的热量为285.8kJ/mol×2mol=571.6kJ;
(4)③C(s)+ ![]() O2(g)=CO(g)ΔH=―110.4 kJ/mol ,④C(s)+O2(g)=CO2(g)ΔH=-393.5kJ/mol,根据盖斯定律分析,④-③得热化学方程式:CO(g) +
O2(g)=CO(g)ΔH=―110.4 kJ/mol ,④C(s)+O2(g)=CO2(g)ΔH=-393.5kJ/mol,根据盖斯定律分析,④-③得热化学方程式:CO(g) + ![]() O2(g)=CO2(g)ΔH=-393.5kJ/mol+110.4 kJ/mol=-110.5 kJ/mol。故燃烧热为-110.5 kJ/mol。
O2(g)=CO2(g)ΔH=-393.5kJ/mol+110.4 kJ/mol=-110.5 kJ/mol。故燃烧热为-110.5 kJ/mol。
(5)碳完全燃烧放出的热量比不完全燃烧多,但焓变为负值,所以△H1<△H2;气态硫的能量比固体硫的能量高,故△H3>△H4。


科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置.下列叙述不正确的是

A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解
D. a和b用导线连接后,Fe片上发生还原反应,溶液中的Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.25℃时将10mLpH=11的氨水加水稀释至100mL时氨水的浓度是0.01mol/L(氨水的Kb=1×10-5)
B.室温下向10mLpH=3的醋酸溶液中加水稀释,溶液中![]() 不变
不变
C.现有浓度均为0.1 mol·L-1的盐酸、硫酸、醋酸三种溶液,分别用以上三种酸溶液中和一定量的NaOH溶液,反应后溶液呈中性,需要酸溶液的体积分别为V1、V2、V3,其大小关系为V3> V1> V2
D.将等体积pH=4的盐酸和醋酸稀释到pH=5的溶液,盐酸所加的水量多,说明盐酸是强酸,醋酸是弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.在轮船表面涂刷富锌油漆,能有效防止船体在海水中被腐蚀
B.0.1mol·L-1氨水加水稀释后,溶液中![]() 的值减小
的值减小
C.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
D.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,△H 能正确表示物质的标准燃烧热的是
A.CO(g)+ ![]() O2(g)=CO2(g) △H =-283 kJ/mol
O2(g)=CO2(g) △H =-283 kJ/mol
B.C(g)+ ![]() O2(g)=CO(g) △H =-110.5 kJ/mol
O2(g)=CO(g) △H =-110.5 kJ/mol
C.H2(g)+ ![]() O2(g)=H2O(g) △H =-248.1 kJ/mol
O2(g)=H2O(g) △H =-248.1 kJ/mol
D.2C2H2(g)+5O2(g)=2H2O(l)+4CO2(g) △H =-2300 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为甲烷晶体的晶胞结构,下列有关说法正确的是( )
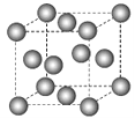
A.甲烷晶胞中的球体只代表一个碳原子
B.晶体中1个![]() 分子有12个紧邻的甲烷分子
分子有12个紧邻的甲烷分子
C.![]() 晶体熔化时需克服共价键
晶体熔化时需克服共价键
D.一个甲烷晶胞中含有8个![]() 分子
分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制氢气的一个重要反应是:CO(g)+H2O(g)=CO2(g)+H2(g)。
已知在25℃时:①C(s)+![]() O2(g)
O2(g)![]() CO(g) H4=-111kJ/mol
CO(g) H4=-111kJ/mol
②H2(g)+![]() O2(g)=H2(g) H2=-242kJ/mol
O2(g)=H2(g) H2=-242kJ/mol
③C(s)+O2(g)=CO2(g) H2=-394kJ/mol
下列说法不正确的是( )
A.25℃时,![]()
B.增大压强,反应①的平衡向逆反应方向移,平衡常数K减小
C.反应①达到平衡时,每生成![]() 的同时生成0.5molO2
的同时生成0.5molO2
D.反应②断开2molH2和1molO2中的化学键所吸收的能量比形成4molO-H键所放出的能量少484kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池的开发和利用是化学学科对人类的一项重大贡献。
(1)某兴趣小组为研究原电池的工作原理,设计了如图所示的实验装置。
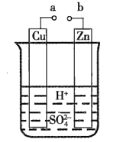
①a和b不连接时,烧杯中发生反应的离子方程式是__。
②a和b用导线连接,Cu极为原电池__(填“正”或“负”)极,电极反应式是__。Zn极发生__(填“氧化”或“还原”)反应。溶液中H+移向__(填“Cu”或Zn”)极。
③无论a和b是否连接,Zn片均被腐蚀。若转移了0.2mol电子,则理论上Zn片质量减轻__g。
(2)有同学想将Ba(OH)2·8H2O与NH4Cl的反应设计成原电池,你认为是否可行?__(填是”或“否”),理由是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁是由![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 离子中的两种组成,可以发生如图转化,下列说法不正确的是
离子中的两种组成,可以发生如图转化,下列说法不正确的是![]()
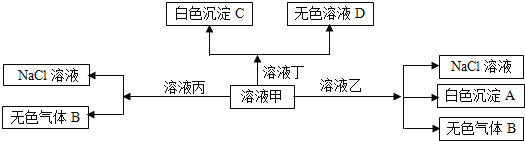
A.在甲中滴加丁可能发生反应:![]()
B.溶液丙中还可以大量共存的离子有:![]() 、
、![]() 、
、![]()
C.白色沉淀A可能溶解在溶液D中
D.甲为![]() ,乙为
,乙为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com