
【题目】下列各组物质,遇到盐酸或强碱溶液都能反应的一组是
A.Cu Al2O3NaHCO3B.Mg Al(OH)3Na2CO3
C.Fe Al2O3Al(OH)3D.Al NaHCO3Al2O3
科目:高中化学 来源: 题型:
【题目】不法分子有时用铜锌合金制成假金币行骗。下列方法中,不能有效鉴别真假的是
A. 在空气中灼烧看表面是否变黑
B. 利用阿基米德原理测密度
C. 用手掂量轻重
D. 滴一滴硝酸在金币的表面,观察现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂醛F (![]() )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:
)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:

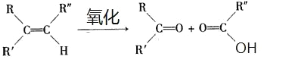
已知:两个醛分子在NaOH溶液作用下可以发生反应,生成一种羟基醛:
![]() +
+ ![]()
![]()
![]()
请回答:
(1)D的名称为__________________。
(2)反应①~⑥中属于加成反应的是___________(填序号)。
(3)写出反应③的化学方程式:______________________________________;
反应④的化学方程式:_________________________________________。
(4)在实验室里鉴定![]() 分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是__________(请按实验步骤操作的先后次序填写序号)。
分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是__________(请按实验步骤操作的先后次序填写序号)。
A.滴加AgNO3溶液 B.加NaOH溶液 C.加热 D.用稀硝酸酸化
(5)E的同分异构体有多种,其中之一甲属于酯类。甲可由H(已知H的相对分子量为32)和芳香酸G制得,则甲的结构共有__________种。
(6)根据已有知识并结合相关信息日,写出以乙烯为原料制备CH3CH=CHCHO的合成路线流程图(无机试剂任选)。合成路线流程图例如下:_____________________
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: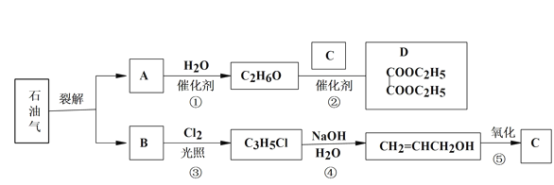
(1)B 和 A 为同系物,B 的结构简式为_____,其含有的官能团名称为_____。
(2)反应①的化学方程式为_____,其反应类型为_____。
(3)写出检验 C3H5Cl 中含有 Cl 原子的方法_____。
(4)C 的结构简式为________。
(5)反应④的化学方程式为________。
(6) 设计一条由乙烯为原料制备 D 的合成路线(其他无机原料任选)。合成路线流程图示例如下:_____
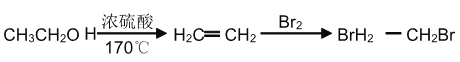
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍 (Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如图所示。下列说法正确的是
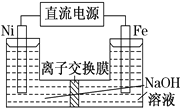
A. 铁是阳极,电极反应为Fe-2e-+2OH-===Fe(OH)2↓
B. 电解一段时间后,镍电极附近溶液的pH减小
C. 每制得1 mol Na2FeO4,理论上可以产生67.2L气体
D. 若离子交换膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)
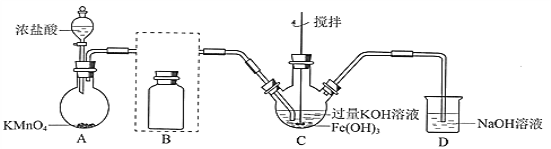
①A为氯气发生装置。A中反应方程式是___________________________________(锰被还原为Mn2+)。
②将除杂装置B补充完整并标明所用试剂 :______________________________
③C中得到紫色固体和溶液。C中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH![]() 2K2FeO4+6KCl+8H2O,另外还有____________________________________(写离子方程式)。
2K2FeO4+6KCl+8H2O,另外还有____________________________________(写离子方程式)。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
i.由方案Ⅰ中溶液变红可知a中含有_______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由__________________________________________产生(用方程式表示)。
ii.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是______________________________。
②根据K2FeO4的制备实验得出:氧化性Cl2_______FeO42-(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】云阳龙缸云端廊桥曾被詟为“世界第一悬挑玻璃景观廊桥”,所用钢化玻璃因其优良的性能广泛应用于日常生活,但由于制作玻璃时里面含有极少量硫化镍,使得钢化玻璃在极限条件下的使用受到限制.
(1)基态硫原子价层电子的轨道表达式(电子排布图)为_____________________
(2)Ni(CO)4常用于制备纯镍,溶于乙醇、CCl4、苯等有机溶剂,为___________晶体,Ni(CO)4
空间构型与甲烷相同,中心原子的杂化轨道类型为___________,写出与配体互为等电子体的阴离子________________________(任写一种).
(3)黄血盐[K4Fe(CN)63H2O]中,三种同周期非金属元素第一电离能由小到大顺序为_________________。
(4)与硫同族的硒元素有两种常见的二元含氧酸,请比较它们酸性强弱 > (填化学式),_________,理由是________________________________________________________.
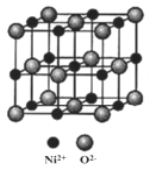
(5)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的空隙中,已知Ni2+半径为69nm,O2-半径为140nm,阿伏伽德罗常数为NA,NiO晶体的密度为________________g/cm3(只列出计算式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2和SO3两种气体的混合物通入BaCl2溶液,其结果是( )
A. 两种气体都被吸收,并有BaSO4沉淀生成
B. 只生成BaSO3沉淀,SO3从溶液中逸出
C. 生成BaSO3和BaSO4两种沉淀
D. 只有BaSO4沉淀,SO2通入溶液中无沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化还原反应的说法中正确的是( )
A.氧化还原反应过程中一定有电子转移
B.氧化还原反应前后一定有氧的得失
C.实现Fe3+→Fe2+的变化过程失去电子
D.失去电子的反应是还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com