
| A. | 常温下,10mL0.2mol/LNH4NO3溶液与10mL0.1mol/LNaOH溶液混合后所得pH=9.6的溶液中:c(NO3-)>c(NH4+)>c(Na+)>(NH3•H2O)>c(OH-)>c(H+) | |
| B. | 0.1mol•L-1Na2S溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) | |
| C. | 室温下,Ka(CH3COOH)=Kb(NH3•H2O)=1.7×10-5,则CH3COOH溶液中c(H+)和NH3•H2O溶液中的c(OH-)相等 | |
| D. | 室温下,向0.10mol•L-1的氨水中加入少量NaOH,溶液中c(NH${\;}_{4}^{+}$)减小,Kw减小 |
分析 A.常温下,10mL0.2mol/LNH4NO3溶液与10mL0.1mol/LNaOH溶液混合反应得到硝酸铵、一水合氨、硝酸钠的混合溶液,所得pH=9.6的溶液显碱性,一水合氨电离程度大于铵根离子水解程度;
B.0.1mol•L-1Na2S溶液中存在电荷守恒,阴阳离子所带电荷数相同;
C.室温下,醋酸溶液中c(H+)=$\sqrt{{K}_{a}c(C{H}_{3}COOH)}$,氨水溶液中c(OH-)=$\sqrt{Kbc(N{H}_{3}•{H}_{2}O)}$;
D.氨水溶液中存在电离平衡加入少量NaOH溶液中氢氧根离子浓度增大,电离平衡逆向进行,但温度不变离子积常数不变.
解答 解:A.常温下,10mL0.2mol/LNH4NO3溶液与10mL0.1mol/LNaOH溶液混合反应得到硝酸铵、一水合氨、硝酸钠的混合溶液,所得pH=9.6的溶液显碱性,一水合氨电离程度大于铵根离子水解程度,溶液中离子浓度c(NO3-)>c(NH4+)>c(Na+)>(NH3•H2O)>c(OH-)>c(H+),故A正确;
B.0.1mol•L-1Na2S溶液中存在电荷守恒,c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),故B错误;
C.室温下,醋酸溶液中c(H+)=$\sqrt{{K}_{a}c(C{H}_{3}COOH)}$,氨水溶液中c(OH-)=$\sqrt{Kbc(N{H}_{3}•{H}_{2}O)}$,两种溶液的浓度相对大小未知,所以无法判断醋酸溶液中氢离子浓度和氨水中氢氧根离子浓度的相对大小,故C错误;
D.氨水溶液中存在电离平衡,NH3•H2O?NH4++OH-,加入少量NaOH溶液中氢氧根离子浓度增大,电离平衡逆向进行,铵根离子浓度减小,离子积常数随温度变化,不随浓度变化,Kw不变,故D错误;
故选A.
点评 本题考查了弱电解质电离平衡和影响因素、溶液酸碱性比较、电解质溶液中电荷守恒等知识点、掌握基础是解题关键,题目难度中等.


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①、②、⑥分子中碳原子数小于10,③、④、⑤、⑦分子中碳原子数大于10 | |
| B. | ①、②是无机物,③、⑤、⑦是有机物 | |
| C. | ①、②是酸性化合物,③、⑤不是酸性化合物 | |
| D. | ②、③、④含氧元素,⑤、⑥、⑦不含氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基-1-丁炔 | B. | 3-甲基-1-丁炔 | C. | 2-甲基-3-丁炔 | D. | 3-甲基-2-丁炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.5mol N2中含有0.5NA个N | |
| B. | 32gO2中含有的氧原子数为2NA | |
| C. | H2的摩尔质量是为2 | |
| D. | 1molH2SO4在水溶液电离出离子约为1.806×1024个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
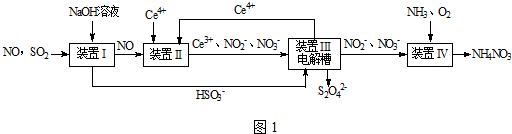
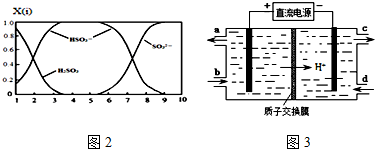
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙炔 | B. | 2-丁炔 | C. | 1-丁烯 | D. | 2-甲基丙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com