
 (1)检验食盐中是否加碘,可利用如下反应:
(1)检验食盐中是否加碘,可利用如下反应:分析 (1)①该反应中I元素化合价由+5价、-1价变为0价,根据转移电子守恒、原子守恒配平方程式;
②得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,根据方程式判断氧化剂和还原剂的物质的量之比;
③生成3molI2转移5mol电子,转移0.2mol电子生成n(I2)=$\frac{0.2mol}{5}×3$;
(2)酸性条件下,亚铁离子和高锰酸根离子反应生成二氧化锰、氢氧化铁和氢离子;
(3)FeI2、FeBr2的混合溶液中通入适量氯气,根据还原性强弱知,离子反应先后顺序是I-、Fe2+、Br-,根据图及离子反应先后顺序知,I的反应为2I-+Cl2=2Cl-+I2、II的反应为2Fe2++Cl2=2Cl-+2Fe3+、III的反应为2Br-+Cl2=2Cl-+Br2,
I-完全反应需要1molCl2,根据2 I-+Cl2=2Cl-+I2知1mol氯气需要2molI-,根据I原子守恒得n(FeI2)=$\frac{1}{2}$n( I-)=$\frac{1}{2}$×2mol=1mol,FeI2中n(Fe2+)=n(FeI2)=1mol;
根据II中2Fe2++Cl2=2Cl-+2Fe3+知,2mol氯气氧化亚铁离子需要4mol亚铁离子,则n(FeBr2)=4mol-1mol=3mol,则n(Br-)=2n(FeBr2)=2×3mol=6mol,根据2Br-+Cl2=2Cl-+Br2知,Br-离子完全反应需要3mol氯气.
解答 解:(1)①该反应中I元素化合价由+5价、-1价变为0价,转移电子数为5,根据转移电子守恒、原子守恒配平方程式为KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O,
故答案为:1;5;3;3;3;3;
②得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,所以碘酸钾是氧化剂、KI是还原剂,根据方程式KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O知,氧化剂和还原剂的物质的量之比为1:5,
故答案为:1:5;
③生成3molI2转移5mol电子,转移0.2mol电子生成n(I2)=$\frac{0.2mol}{5}×3$=0.12mol,故答案为:0.12 mol;
(2)酸性条件下,亚铁离子和高锰酸根离子反应生成二氧化锰、氢氧化铁和氢离子,离子方程式为3Fe2++7H2O+MnO4-═MnO2+3Fe(OH)3↓+5H+,
故答案为:3Fe2++7H2O+MnO4-═MnO2+3Fe(OH)3↓+5H+;
(3)FeI2、FeBr2的混合溶液中通入适量氯气,根据还原性强弱知,离子反应先后顺序是I-、Fe2+、Br-,根据图及离子反应先后顺序知,I的反应为2I-+Cl2=2Cl-+I2、II的反应为2Fe2++Cl2=2Cl-+2Fe3+、III的反应为2Br-+Cl2=2Cl-+Br2,
I-完全反应需要1molCl2,根据2 I-+Cl2=2Cl-+I2知1mol氯气需要2molI-,根据I原子守恒得n(FeI2)=$\frac{1}{2}$n( I-)=$\frac{1}{2}$×2mol=1mol,FeI2中n(Fe2+)=n(FeI2)=1mol;
根据II中2Fe2++Cl2=2Cl-+2Fe3+知,2mol氯气氧化亚铁离子需要4mol亚铁离子,则n(FeBr2)=4mol-1mol=3mol,则n(Br-)=2n(FeBr2)=2×3mol=6mol,根据2Br-+Cl2=2Cl-+Br2知,Br-完全反应需要3mol氯气.
①通过以上分析知,n(FeBr2)=3mol,故答案为:3;
②根据以上分析知,n(Fe2+):n(I-):n(Br-)=4mol:2mol:6mol=2:1:3,故答案为:2:1:3;
③溴离子完全反应需要3mol氯气,则a=3+3=6,故答案为:6;
④当通入2mol Cl2时,有1mo氯气和碘离子反应,有1mol氯气和亚铁离子反应,所以离子方程式为2Fe2++2I-+2Cl2═I2+2 Fe3++4Cl-,
故答案为:2Fe2++2I-+2Cl2═I2+2 Fe3++4Cl-.
点评 本题考查氧化还原反应有关计算、氧化还原反应方程式的配平等知识点,为高频考点,明确离子反应先后顺序是解本题关键,注意图中每一阶段发生的反应,为易错点.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 把一块镁铝合金投入到1mol/L HCl溶液里,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是( )
把一块镁铝合金投入到1mol/L HCl溶液里,待合金完全溶解后,再往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是( )| A. | HCl溶液的体积为80mL | B. | a的取值范围为0≤a<50 | ||
| C. | 当a值为30时,b值为0.01 | D. | $\frac{n(Mg)}{n(Al)}$的最大值为2.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO42-+NH4+═BaSO4↓+NH3•H2O+H2O | |
| B. | 在100 mL浓度为1 mol•L-1的 Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| C. | 硫化钠的水解:S2-+H2O?HS-+OH- | |
| D. | NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学是一门“中心的、实用的、创造性的”科学,在能源、资源的合理开发和安全应用方面有重要的作用 | |
| B. | 胶体与其它分散系的本质区别是胶体有丁达尔效应,而其它分散系却没有 | |
| C. | 借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有哪些非金属元素 | |
| D. | 提出原子结构模型的科学家按时间先后依次是:道尔顿、卢瑟福、汤姆生、玻尔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1:1 | B. | 2:2:1:2 | C. | 1:3:1:1 | D. | 4:3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
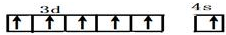 ,B在元素周期表的位置第二周期第ⅣA族
,B在元素周期表的位置第二周期第ⅣA族查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用石墨作电极电解氯化镁溶液:2H2O+2Cl-$\frac{\underline{\;电解\;}}{\;}$-H2↑+Cl2↑+2OH- | |
| B. | 用过量氨水吸收工业尾气中的SO2:2NH3•H20+SO2=2NH4++SO32-+H2O | |
| C. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+3H2O | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀: 2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com