
| A. | 铁元素的化合价是+3 | |
| B. | 铁离子的配位数是3 | |
| C. | C2O42-中碳原子的杂化方式为sp3 | |
| D. | 该物质中含有离子键,配位键和极性共价键 |
分析 A.元素化合价的代数和为零计算;
B.铁离子的配位数是6;
C.根据C原子的价层电子对数判断;
D.K3[Fe(C2O4)3]中含有离子键、配位键、共价键.
解答 解:A.元素化合价的代数和为零,在K3[Fe(C2O4)3]中K为+1价,C2O42-为-2价,所以铁元素的化合价是+3,故A正确;
B.K3[Fe(C2O4)3]中铁离子的配位数是6,故B错误;
C.C2O42-的结构式为[-O-$\stackrel{\stackrel{O}{∥}}{C}$-$\stackrel{\stackrel{O}{∥}}{C}$-O-],每个C原子含有3个价层电子对,所以碳原子的杂化方式为sp2,故C错误;
D.K3[Fe(C2O4)3]中钾离子与配离子之间形成离子键,配离子中含有配位键,C与O之间存在共价键,故D正确.
故选AD.
点评 本题考查了化合价、配位键、共价键、离子键以及杂化类型的判断,题目难度不大,侧重于基础知识的考查,注意把握有机物分子中C原子杂化类型的判断方法.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
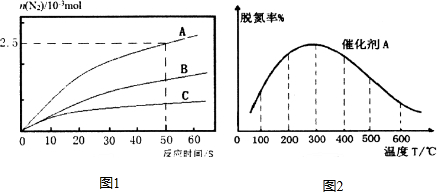 研究发现,NOx是雾霾的主要成分之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.
研究发现,NOx是雾霾的主要成分之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
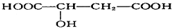 ,苹果酸可能发生的反应是( )
,苹果酸可能发生的反应是( )| A. | ①②③ | B. | ①②③④ | C. | ①②③⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
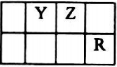 己知X、Y、Z、Q、R是原子序数依次增大的短周期元素,X和Q位于同主族,Y、Z、R在元素周期表中的相对位置如图所示,其中Q与R属于同周期.且R的单质常温下是一种黄绿色气体,X2Z2分子和R-离子具有相同的电子数,请回答:
己知X、Y、Z、Q、R是原子序数依次增大的短周期元素,X和Q位于同主族,Y、Z、R在元素周期表中的相对位置如图所示,其中Q与R属于同周期.且R的单质常温下是一种黄绿色气体,X2Z2分子和R-离子具有相同的电子数,请回答: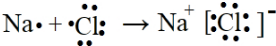 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
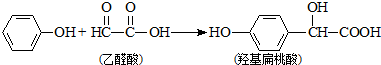
| A. | 苯酚和羟基扁桃酸互为同系物 | |
| B. | 常温下,1mol羟基扁桃酸只能与2molBr2反应发生加成反应 | |
| C. | 羟基扁桃酸分子中至少有12个原子共平面 | |
| D. | 乙醛酸的核磁共振氢谱中只有1个吸收峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
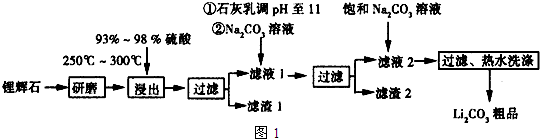
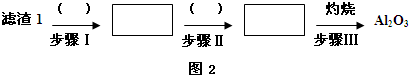
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com