
【题目】用 NA 表示阿伏加德罗常数的值,下列说法正确的是()
A.电解精炼铜,当外电路通过 NA 个电子时,阳极质量减小 32 g
B.反应 3H2(g)+N2(g)![]() 2NH3(g)ΔH=-92 kJ·mol-1,当放出 9.2 kJ 热量时,反应的 N2 为2.24L
2NH3(g)ΔH=-92 kJ·mol-1,当放出 9.2 kJ 热量时,反应的 N2 为2.24L
C.常温常压下 27 克 Al 与 33.6L 氯气完全反应,电子转移数小于 3NA
D.1 mol·L-1 氯化铜溶液中,若 Cl-的数目为 2NA,则 Cu2+的数目略小于 NA
【答案】D
【解析】
A.电解精炼铜时,阳极上放电的除了铜,还有比铜活泼的金属杂质,故当转移NA个电子时,阳极减少的质量不等于32g,故A错误;
B.反应3H2(g)+N2(g)2NH3(g)ΔH=-92 kJ·mol-1,转移6mol电子,放出热量9.2kJ时,转移电子0.6NA,反应的N2标况下为2.24L,故B错误;
C.常温常压下与33.6L氯气的物质的量小于1.5mol, 所以与27克Al不能完全反应,故C错误;
D.氯化铜的化学式为CuCl2,n( Cu2+): n(Cl-)= 2:1,所以在1mol·L-1氯化铜溶液中,若Cl-的数目为2NA,则Cu2+水解少量消耗,数目略小于NA,故D正确;
故选D。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】花椒毒素(H)有抗实验性心律失常、镇痛、抗炎等作用。由芳香族化合物A为原料合成H的一种合成路线如下:
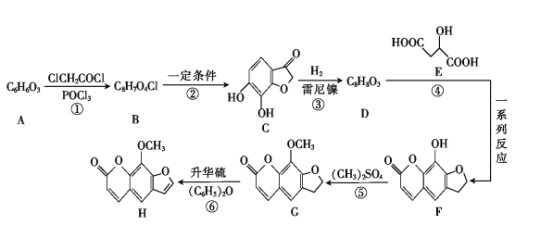
已知:![]() +ClCH2CH2Cl
+ClCH2CH2Cl![]()
![]() +HCl
+HCl
回答下列问题:
(1)A的化学名称是 _____(用系统命名法)。
(2)G中所含官能团的名称是 ____。
(3)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。E中___ (填“有”或“没有”)手性碳。
(4)反应⑥的反应类型是 ____ 。
(5)D的结构简式为 _____。
(6)F与足量NaOH溶液反应的化学方程式为 ____。
(7)芳香族化合物W是D的同分异构体,能发生银镜反应和水解反应,遇FeCl3溶液发生显色反应;W的核磁共振氢谱有5组峰,且面积比为1∶2∶2∶2∶1。符合上述要求的W有____种。
(8)有机物M(![]() )是一种重要的化工原料。设计由邻苯二酚和氯乙酰氯(ClCH2COCl)为起始原料制备有机物M的合成路线____。(无机试剂及有机溶剂任用)
)是一种重要的化工原料。设计由邻苯二酚和氯乙酰氯(ClCH2COCl)为起始原料制备有机物M的合成路线____。(无机试剂及有机溶剂任用)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配离子的稳定性可用K不稳衡量,例如Ag(NH3)2]+的K不稳=![]() 。在一定温度下,向0.1 mol/L硝酸银溶液中滴入稀氨水,发生反应Ag++2NH3[Ag(NH3)2]+]。溶液中pNH3与δ(X)的关系如图。其中pNH3=-lg[c(NH3)]、δ(X)=
。在一定温度下,向0.1 mol/L硝酸银溶液中滴入稀氨水,发生反应Ag++2NH3[Ag(NH3)2]+]。溶液中pNH3与δ(X)的关系如图。其中pNH3=-lg[c(NH3)]、δ(X)=![]() (X代表Ag+或Ag(NH3)2]+。下列说法不正确的是
(X代表Ag+或Ag(NH3)2]+。下列说法不正确的是
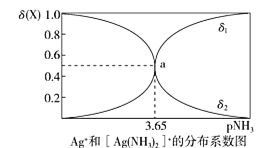
A.图中δ2代表的是δ([Ag(NH3)2]+])B.向溶液中滴入稀硝酸,δ(Ag+)减小
C.该溶液中c(NH4+)+c(H+)=c(OH-)D.该温度时,K不稳([Ag(NH3)2]+)=10-7.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组模拟“人工树叶”电化学装置如下图所示,该装置能将H2O和CO2转化为糖类(C6H12O6)和O2,X、Y是特殊催化剂型电极,下列说法正确的是
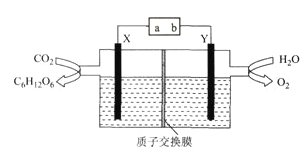
A. 电源a极为正极
B. 该装置中Y电极发生还原反应
C. X电极的电极反应式为6CO2+24H++24e-=C6H12O6+6H2O
D. 理论上,每生成22.4L(标准状况下)O2,必有4mol H+由X极区向Y极区迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镇痛药物J的合成方法如下:
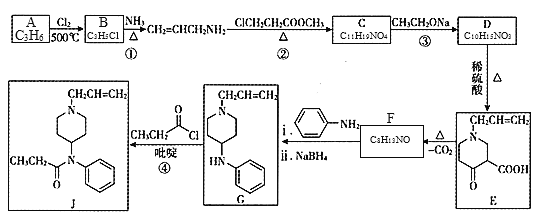
已知:
![]() +Cl-R3
+Cl-R3![]()
![]() +HCl
+HCl
R1COOR2+R3CH2COOR4![]()
![]() +R2OH
+R2OH
![]()
![]()
![]()
(R1、R2、R3、R4为氢或烃基)
(1)B的名称为______;F的结构简式为______。
(2)C中含氧官能团名称为______;②的反应类型为______反应。
(3)③的化学方程式为______。
(4)有机物K分子组成比F少两个氢原子,符合下列要求的K的同分异构体有______种。
A.遇FeCl3显紫色 B.苯环上有三个取代基
(5)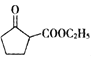 是一种重要的化工中间体。以环已醇(
是一种重要的化工中间体。以环已醇(![]() )和乙醇为起始原料,结合己知信息选择必要的无机试剂,写出
)和乙醇为起始原料,结合己知信息选择必要的无机试剂,写出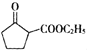 的合成路线______。(已知:RHC=CHR
的合成路线______。(已知:RHC=CHR![]() RCOOH+R′COOH,R、R′为烃基。用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
RCOOH+R′COOH,R、R′为烃基。用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,中国科学院大连物化所CO2催化转化为CO的研究获得新成果。如图是使用不同催化剂(NiPc和CoPc)时转化过程中的能量变化。下列说法不合理的是( )
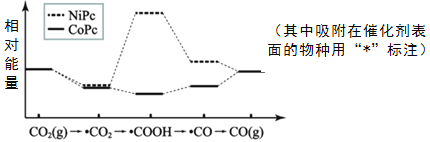
A.转化过程中有极性键形成
B.*CO2经氧化反应得到*COOH
C.吸附在NiPc和CoPc表面带有相同基团的物种其能量不同
D.该研究成果有利于缓解温室效应并解决能源转化问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:MOH碱性比NOH强。常温下,用HCl气体分别改变浓度均为0.1mol·L-1的MOH溶液和NOH溶液的pH(溶液体积变化忽略不计),溶液中M+、N+的物质的量浓度负对数与溶液的pH关系如下图,pR=-lgc(M+)或-lgc(N+),下列说法错误的是( )
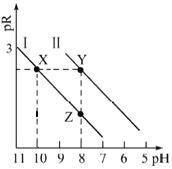
A.曲线I表示-lgc(M+)与pH关系
B.常温下,电离常数![]() =100
=100
C.溶液中水的电离程度:Y>X
D.对应溶液中c(Cl-):Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )

A. 每生成2 mol AB吸收bkJ热量
B. 该反应热△H= + (a-b)kJ mol-1
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1 mol A—A和1 mol B—B键,放出akJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如图:
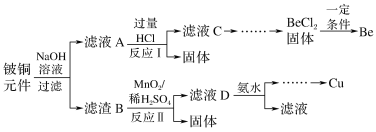
已知:Ⅰ.铍、铝元素的化学性质相似,单质铍与氢氧化钠溶液反应生成可溶于水的Na2BeO2
Ⅱ.常温下部分难溶物的溶度积常数如下表:
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
溶度积常数(Ksp) | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(1)滤液A的主要成分除NaOH外,还有__(填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式:__。
(2)①滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序为__(填字母)。
a.加入过量的氨水 b.通入过量的CO2 c.加入过量的NaOH d.加入适量的HCl e.洗涤 f.过滤
②从BeCl2溶液中得到BeCl2固体的操作是__。
(3)①MnO2能将金属硫化物中的硫元素氧化为硫单质。写出反应Ⅱ中CuS发生反应的化学方程式:__。
②若用浓HNO3溶解金属硫化物,缺点是__(任写一条)。
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可将其依次分离,首先沉淀的是__(填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH大于__。
(5)电解NaCl-BeCl2混合熔盐可制备金属铍,如图是电解装置图。
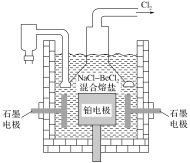
①石墨电极上的电极反应式为__。
②电解得到的Be蒸气中约含1%的Na蒸气除去Be中少量Na的方法为__。
已知部分物质的熔、沸点如下表:
物质 | 熔点(K) | 沸点(K) |
Be | 1551 | 3243 |
Na | 370 | 1156 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com