
 写出B的化学式Fe2O3
写出B的化学式Fe2O3分析 A由X、Y两种元素组成.在空气中充分灼烧得到含X元素的8g红棕色固体B,则B为Fe2O3,X为Fe,产生能使品红褪色的气体C,将该气体全部通入足量的双氧水中得D溶液,再向D溶液中加入足量的BaCl2溶液,得到46.6g固体,该固体为BaSO4,故C为SO2,D为H2SO4,则Y为S,氧化铁的物质的量=$\frac{8g}{160g/mol}$=0.05mol,硫酸钡的物质的量=$\frac{46.6g}{233g/mol}$=0.2mol,根据原子守恒化合物A中Fe、S原子数目之比=0.05mol×2:0.2mol=1:2,故A为FeS2,然后结合物质的性质及化学用语来解答.
解答 解:A由X、Y两种元素组成.在空气中充分灼烧得到含X元素的8g红棕色固体B,则B为Fe2O3,X为Fe,产生能使品红褪色的气体C,将该气体全部通入足量的双氧水中得D溶液,再向D溶液中加入足量的BaCl2溶液,得到46.6g固体,该固体为BaSO4,故C为SO2,D为H2SO4,则Y为S,氧化铁的物质的量=$\frac{8g}{160g/mol}$=0.05mol,硫酸钡的物质的量=$\frac{46.6g}{233g/mol}$=0.2mol,根据原子守恒化合物A中Fe、S原子数目之比=0.05mol×2:0.2mol=1:2,故A为FeS2,
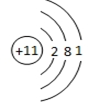
(1)X为Fe,位于元素周期表中第四周期第VIII族;S2-的结构示意图为 ;由上述分析可知B为Fe2O3,
;由上述分析可知B为Fe2O3,
故答案为:第四周期第VIII族; ;Fe2O3;
;Fe2O3;
(2)气体C通入H2O2中,发生氧化还原反应生成硫酸,反应的离子方程式为SO2+H2O2=2H++SO42-,故答案为:SO2+H2O2=2H++SO42-;
(3)将FeS2溶于H2SO4的稀溶液中生成E,并产生一种单质和一种气体,应生成硫酸亚铁、硫化氢、硫,该反应的化学方程式为FeS2+H2SO4=H2S↑+S↓+FeSO4,
故答案为:FeS2+H2SO4=H2S↑+S↓+FeSO4;
(4)将化合物FeSO4隔绝空气充分灼烧,使其分解,生成等物质的量的Fe2O3、SO2和另一种化合物,根据原子守恒,则另一种化合物的化学式是SO3;有同学认为该分解反应得到的固体产物中除Fe2O3外,还可能会有含Fe元素的低价态物质,该同学的观点合理,因为分解反应可能部分发生非氧化还原反应,
故答案为:SO3;合理;分解反应可能部分发生非氧化还原反应.
点评 本题考查无机物的推断,为高频考点,把握S及其化合物、Fe及其化合物的性质、相互转化为解答的关键,侧重分析与推断能力的考查,注意品红褪色、固体的颜色及白色沉淀为推断的突破口,题目难度中等.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 3.00g | B. | 3.43g | C. | 4.50g | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠块在乙醇的液面上游动 | B. | 钠块并不熔化 | ||
| C. | 钠块沉在乙醇液面下面 | D. | 钠块表面有气体放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
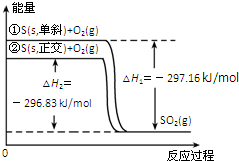
| A. | S(s,单斜)═S(s,正交)△H=+0.33kJ•mol-1 | |
| B. | 正交硫比单斜硫稳定 | |
| C. | 单斜硫燃烧的热化学方程式为:S(s,单斜)+O2(g)═SO2(g)△H=-296.83kJ•mol-1 | |
| D. | ①式表示断裂1 molO2中的共价键所吸收的能量比形成1 molSO2 中的共价键所放出的能量少297.16kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅①③④ | B. | 仅②③④ | C. | 仅①③④⑤ | D. | 仅①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,G在元素周期表中的位置为第三周期第ⅤⅡA族.
,G在元素周期表中的位置为第三周期第ⅤⅡA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入足量CO2后的溶液中大量共存:Na+、SiO32-、CH3COO-、CO32- | |
| B. | pH=9的CH3COONa溶液和pH=9的NH3•H2O溶液,两溶液中水的电离程度相同 | |
| C. | NH4Al(SO4)2溶液中滴加足量的NaOH的离子方程式为:NH4++Al3++5OH-=NH3•H2O+AlO2-+2H2O | |
| D. | Fe2+、SO2都能使酸性高锰酸钾溶液褪色,前者表现出还原性,后者表现出漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2、SO2、H2SiO3、NH4Cl | B. | Al、CO、HCl、Al(NO3)3 | ||
| C. | N2、SiO2、CH3COOH、Na2CO3 | D. | Fe CaO、NH3H2O NaHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com