
【题目】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型: C、D为同周期元素,C核外电子总数是最外层层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是___________(填元素符号),其中C原子的核外电子排布式为__________。
(2)单质A有两种同素异形体,其中沸点高的是____________(填分子式);A和B的氢化物所属的晶体类型分别为___________和___________。
(3)C和D反应可生成组成比为1:3的化合物E,E的立体构型为____________,中心原子的杂化轨道类型为________________。
(4)单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为______________。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为________;晶胞中A原子的配位数为____________;列式计算晶体F的密度(g cm-3 )__________。
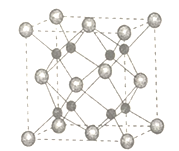
【答案】O ls22s22p63s23p3(或[Ne]3s23p3) O3 分子晶体 离子晶体 三角锥形 sp3 2Cl2+2Na2CO3+H2O=Cl2O+2NaHCO3+2NaCl(或2Cl2+Na2CO3=Cl2O+CO2+2NaCl) Na2O 8 2.27 g/cm3
【解析】
A、B、C、D为原子序数依次增大的四种元索,C核外电子总数是最外层电子数的3倍,则C为P元素,C、D为同周期元索,D元素最外层有一个未成对电子,则D为Cl元素,A2-和B+具有相同的电子构型,则A为O、B为Na元素;通过以上分析,A、B、C、D分别是O、Na、P、Cl元素。
(1)元素的非金属性越强,其电负性越大,这几种元素非金属性最强的是O元素,则电负性最大的是O元素;C是P元素,其原子核外有15个电子,根据构造原理书写P原子核外电子排布式为ls22s22p63s23p3(或[Ne]3s23p3);故答案为:O;ls22s22p63s23p3(或[Ne]3s23p3);
(2)单质A为氧气,氧气的同素异形体是臭氧,二者都是分子晶体,分子晶体熔沸点与范德华力成正比,范德华力与相对分子质量成正比,臭氧的相对分子质量大于氧气,则范德华力:臭氧>氧气,所以熔沸点较高的是O3;A和B的氢化物所属的晶体类型分别为水是分子晶体和NaH为离子晶体。故答案为:O3;分子晶体;离子晶体;
(3)C和D反应可生成组成比为1:3的化合物PCl3,PCl3中P原子价层电子对个数=3+![]() =4且含1个孤电子对,根据价层电子对互斥理论判断该分子的立体构型为三角锥形、中心原子的杂化轨道类型为sp3,故答案为:三角锥形;sp3;
=4且含1个孤电子对,根据价层电子对互斥理论判断该分子的立体构型为三角锥形、中心原子的杂化轨道类型为sp3,故答案为:三角锥形;sp3;
(4)单质Cl2与湿润的Na2CO3反应可制备Cl2O,其化学方程式为2Cl2+2Na2CO3+H2O= Cl2O+2NaHCO3+2NaCl (或2Cl2+Na2CO3=Cl2O+CO2+2NaCl)。故答案为:2Cl2+2Na2CO3+H2O= Cl2O+2NaHCO3+2NaCl (或2Cl2+Na2CO3=Cl2O+CO2+2NaCl);
(5)O和Na能够形成化合物F,半径大的为O元素离子、半径小的为Na+,该晶胞中大球个数=8×![]() +6×
+6×![]() =4、小球个数为8,则大球、小球个数之比=4:8=1:2,则化学式为Na2O;观察晶胞中面心的原子,与之相连的原子有8个,晶胞中O原子的配位数为8;该晶胞体积=a3nm3,晶胞密度=
=4、小球个数为8,则大球、小球个数之比=4:8=1:2,则化学式为Na2O;观察晶胞中面心的原子,与之相连的原子有8个,晶胞中O原子的配位数为8;该晶胞体积=a3nm3,晶胞密度= =
=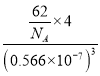 g·cm-3=2.27g·cm-3;故答案为:Na2O;2.27g·cm-3。
g·cm-3=2.27g·cm-3;故答案为:Na2O;2.27g·cm-3。


科目:高中化学 来源: 题型:
【题目】化合物W是一种医药化工合成中间体,其合成路线如下:

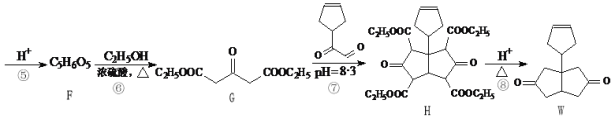
(1)B中官能团的名称是________和_________。
(2)反应④的反应类型是________。
(3)F的结构简式是_________。
(4)芳香化合物X是W的同分异构体,X能够发生银镜反应,核磁共振氢谱有五组峰,峰面积之比为6:4:3:2:1,写出X的一种结构简式:________。
(5)写出以1,2-二氯乙烷和![]() 为原料合成
为原料合成![]() 的合成路线流程图(无机试剂可任选)_________________。合成路线流程图示例如下:
的合成路线流程图(无机试剂可任选)_________________。合成路线流程图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在体积为10L的密闭容器中,3molX和1molY进行应:2X(g)+Y(g)![]() Z(g),经2min达到平衡,生成0.6molZ,下列说法正确的是
Z(g),经2min达到平衡,生成0.6molZ,下列说法正确的是
A. 以X浓度变化表示的反应速率为0.01mol/(L·s)
B. 将容器体积变为20L,Z的平衡浓度为原来的1/2
C. 若增大压强,则物质Y的转化率减小
D. 若升高温度,X的体积分数增大,则该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员研制出一种室温“可呼吸” Na-CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。吸入CO2时,其工作原理如图所示。吸收的全部CO2中,有2/3转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是
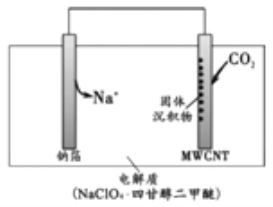
A.“吸入”CO2时,钠箔为正极
B.“呼出”CO2时,Na+向多壁碳纳米管电极移动
C.“吸入” CO2时的正极反应式为:4Na++3CO2+4e-=2Na2CO3+C
D.标准状况下,每“呼出”22.4 L CO2,转移电子的物质的量为0.75 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述的化学反应状态,不一定是平衡状态的是( )
A.H2(g)+Br2(g)![]() 2HBr(g),恒温、恒容下,反应体系中气体的颜色保持不变
2HBr(g),恒温、恒容下,反应体系中气体的颜色保持不变
B.2NO2(g) ![]() N2O4(g),恒温、恒容下,反应体系中气体的压强保持不变
N2O4(g),恒温、恒容下,反应体系中气体的压强保持不变
C.CaCO3(s) ![]() CO2(g)+CaO(s),恒温、恒容下,反应体系中气体的质量保持不变
CO2(g)+CaO(s),恒温、恒容下,反应体系中气体的质量保持不变
D.3H2(g)+N2(g) ![]() 2NH3(g),反应体系中H2与N2的物质的量之比保持3∶1
2NH3(g),反应体系中H2与N2的物质的量之比保持3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种主族元素的单质在常温下都是常见的无色气体,在适当条件下,三者之间可以两两发生反应生成分别是双核、三核和四核的甲、乙、丙三种分子,且乙、丙分子中含有X元素的原子个数比为2∶3。请回答下列问题:
(1)元素Y在周期表中的位置是___,丙分子的电子式为____。
(2)若甲与Y单质在常温下混合就有明显红棕色气体的现象,则甲的化学式为___。丙在一定条件下转化为甲和乙的反应方程式为___。
(3)化合物丁含X、Y、Z三种元素,丁是一种常见的强酸,将丁与丙按物质的量之比1∶1混合后所得物质戊的晶体结构中含有的化学键为___(选填序号)。
a.只含共价键 b.只含离子键 c.既含离子键,又含共价键
写出戊与烧碱的浓溶液加热时反应的离子方程式___。
(4)在标准状况下,用装满丙气体的烧瓶做喷泉实验,喷泉结束后水充满烧瓶,假设烧瓶中溶质不能扩散出来,则所得溶液的物质的量浓度为____。(保留两位有效数字)
(5)X与Y两种元素之间可形成一种18e-微粒的分子,此分子是医疗上常用的消毒剂,请写出此分子的结构式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大___min(填0~1、1~2、2~3、3~4、4~5),原因是____。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率___(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是(________)
A.蒸馏水
B.KCl溶液
C.KNO3溶液
D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
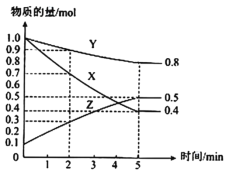
①该反应的化学方程式是___。
②该反应达到平衡状态的标志是___。
A.X、Y、Z的反应速率相等
B.X、Y的反应速率比为3:1
C.容器内气体压强保持不变
D.生成1molY的同时生成2molZ
③2min内X的转化率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是锌片和铜片在稀硫酸中所组成的原电池装置,c、d为两个电极。下列有关的判断不正确的是( )
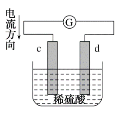
A.电池工作的过程中,溶液中SO![]() 浓度基本不变
浓度基本不变
B.电池工作时,溶液中SO![]() 向c移动
向c移动
C.c为负极,发生氧化反应
D.电池工作的过程中,c电极上产生气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代文化蕴藏了很多化学知识,下列有关说法不正确的是
A. “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化
B. “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
C. “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
D. “丹砂(HgS)烧之成水银,积变又还成丹砂”描述的是分解反应和化合反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com