
| A. | 常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为c(Cl-)>c(NH+4)>c(H+)>c(OH-) | |
| B. | 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 | |
| D. | 将pH=4的醋酸溶液和pH=10的氢氧化钠溶液等体积混合,所得溶液的pH一定大于7 |
分析 A.常温下,pH=7的溶液中c(H+)=c(OH-),根据电荷守恒判断;
B.醋酸是弱电解质,稀释醋酸溶液时促进醋酸电离,除了氢氧根离子浓度外,其它离子浓度都减小;
C.常温下,硫离子的第一步水解程度大于第二步,酸性越强,对应的酸根离子的水解程度越弱;
D.混合液中醋酸过量,溶液呈酸性.
解答 解:A.常温下,pH=7的溶液中c(H+)=c(OH-),溶液中存在电荷守恒,根据电荷守恒c(Cl-)+c(OH-)=c(NH4+)+c(H+)可知:c(Cl-)=c(NH4+),故A错误;
B.醋酸是弱电解质,稀释醋酸溶液时促进醋酸电离,醋酸根离子和氢离子浓度都减小,温度不变,水的离子积常数不变,所以氢氧根离子浓度增大,故B错误;
C.常温下,硫离子的第一步水解程度大于第二步,则H2S的酸性较强,所以同浓度的Na2S与NaHS溶液相比,Na2S的水解程度较大,其溶液的pH较大,故C正确;
D.pH=4的醋酸溶液中,醋酸的浓度大于0.0001mol/L,pH=10的氢氧化钠溶液的浓度为0.0001mol/L,两溶液等体积混合后醋酸过量,溶液呈酸性,则溶液的pH<7,故D错误;
故选C.
点评 本题考查较为综合,涉及弱电解质的电离以及pH的计算,为高频考点,题目难度中等,侧重于学生的分析和计算能力的考查,注意把握弱电解质的电离特点,试题培养了学生的分析能力及灵活应用能力.


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:实验题
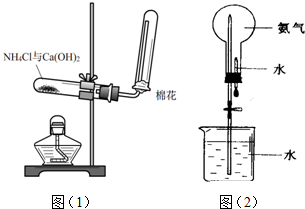
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-和NH3分子均为内界 | B. | 该配合物可能是平面正方形结构 | ||
| C. | 配合物中心Pt4+的配位数为4 | D. | 该配合物中有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
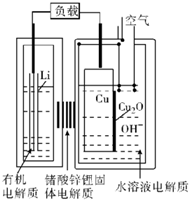 近年来AIST报告正在研究一种“高容量、低成本”锂-铜空气燃料电池.该电池放电时的反应过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )
近年来AIST报告正在研究一种“高容量、低成本”锂-铜空气燃料电池.该电池放电时的反应过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )| A. | 放电时,Li+透过固体电解质向Cu极移动 | |
| B. | 放电时,Cu作电池的负极 | |
| C. | 通空气时,铜被氧化,表面产生Cu2O | |
| D. | 整个反应过程中,铜相当于催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
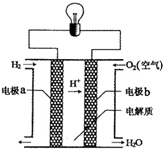 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法正确的是( )| A. | 该电池工作时电能转化为化学能 | |
| B. | 该电池中电极b是负极 | |
| C. | 外电路中电子由电极b通过导线流向电极a | |
| D. | 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
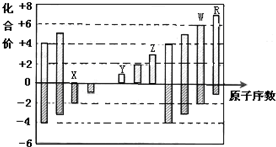
| A. | X的氢化物形成的晶体中存在的最强作用力是分子间作用力 | |
| B. | R的气态氢化物溶于水,离子键断裂 | |
| C. | W的气态氢化物是离子化合物 | |
| D. | Y和Z两者最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ②③ | C. | ①② | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com