
(10分)(1)实验室要配制100 mL 2 mol/L NaCl溶液,请回答下列问题:
(1)配制过程中需要使用的主要玻璃仪器包括烧杯、玻璃棒、胶头滴管、量筒和___________。
(2)用托盘天平称取氯化钠固体,其质量为__________ g。
(3)列主要操作步骤的正确顺序是___________(填序号)。
①称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③将溶液转移到容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)如果实验过程中缺少步骤⑤,会造成所配溶液的物质的量浓度_______(填“偏高”或“偏低”或“无影响”,下同);若定容时俯视容量瓶刻度 线,会造成所配溶液的物质的量浓度_________。
(2)实验室可用如图装置制备少量蒸馏水:
①温度计水银球处于 处,全程严格控制好温度
②液体量不超过烧瓶体积的1/3,投放少量碎瓷片,防止_________。
③先通冷凝水,再加热;冷凝管中的水流方向应为 ;
④刚开始收集到的馏分应弃去;结束时先 ,再 。
(1)100 mL容量瓶 (2)11.7 (3)①③⑤②④ (4)偏低 偏高(2)支管口 暴沸 下进上出 停止加热 关闭冷凝水
解析试题分析:(1)配制一定物质的量浓度的溶液一定要用到容量瓶,(2)NaCl的物质的量为n="cV=2" mol/L×0.1L=0.2mol,质量为m="nM=0.2" mol×58.5g/mol=11.7g(3)配制一定物质的量浓度溶液时主要操作有:称量、溶解、移液,洗涤、定容、摇匀等,故操作顺序是①③⑤②④。(4)如果实验过程中缺少步骤⑤,会造成溶质与损失,那么浓度会偏小,若定容时俯视容量瓶刻度线会造成溶液的体积偏小,浓度就偏大。(2)这是个蒸馏装置图①温度计水银球处于支管口处。②碎瓷片作用是防止液体暴沸。③冷凝管中的水流方向应为下进上出。④蒸馏结束时停止加热再关闭冷凝水,让最后的气体成分冷却。
考点:一定物质的量浓度溶液的配制和蒸馏操作。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:单选题
下列所述情况中,可能引起水污染的是:
①城市生活污水的任意排放 ②农业生产中农药、化肥使用不当
③海上油轮石油泄漏 ④工业生产中废液、废渣、废气的排放
| A.只有①③ | B.只有①④ | C.只有②④ | D.①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
12分)某学生欲配制6.0mol/L的H2SO41000mL,实验室有三种不同浓度的硫酸:①480mL0.5mol/L的硫酸;②150mL25%的硫酸(ρ=1.18g/mL);③足量的18mol/L的硫酸。有三种规格的容量瓶:250mL、500mL、1000mL。老师要求把①②两种硫酸全部用完,不足的部分由③来补充。请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为 mol/L(保留1位小数)。
(2)配制该硫酸溶液应选用容量瓶的规格为 mL。
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的18mol/L的浓硫酸 mL,沿玻璃棒倒入上述混合液中。并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D._____________________________________;
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2cm处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)如果省略操作D,对所配溶液浓度有何影响? (填“偏大”、“偏小”或“无影响”)。
(5)进行操作C前还需注意 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(9分)已知某硫酸和盐酸的混合溶液中,H+的浓度为0.1mol/L,将50mL上述混合溶液与50mLBa(OH)2溶液混合,充分反应后过滤,得0.466g沉淀,溶液(100mL)中OH-的浓度为0.1mol/L。试求:
(1)原混合溶液中SO42-、Cl-的物质的量。
(2)Ba(OH)2溶液的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(10分)某同学帮助水质检测站配制480 mL 0.5 mol·L-1 NaOH溶液以备使用。
(1)该同学应选择________mL的容量瓶。
(2)其操作步骤如下图所示,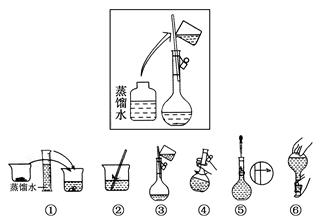
则如图操作应在下图中的________(填选项字母)之间。
A.②与③ B.①与② C.④与⑤
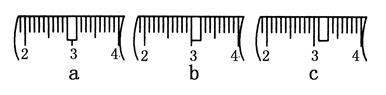
(3)该同学应称取NaOH固体________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小________(填字母),并在下图中选出能正确表示游码位置的选项________(填字母)。
附表 砝码规格
| | a | b | c | d | e |
| 砝码大小/g | 100 | 50 | 20 | 10 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(17分)科学探究
某学习小组根据图中所示的电解水原理进行实验,并对实验得到的与查阅资料获得的数据进行处理、分析,请与他们一起进行探究。请按要求填写。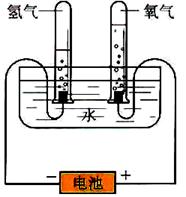
(1)观察不同时间试管内的H2和O2体积的比值均约为 。
(2)假设电解了1.8g H2O,根据电解水的化学方程式计算生成H2、O2的质量,计算过程如下:
并填表如下:
| | 质量g | 物质的量mol | H2和O2物质的量的比 |
| H2 | | | |
| O2 | | |
| 条件 | 物质 | 1 mol物质的体积 |
| 0℃101kPa | H2 | 22.3 L |
| O2 | 22.4 L | |
| CO2 | 22.4 L | |
| 25℃101kPa | H2 | 24.4L |
| O2 | 24.5L | |
| CO2 | 24.5L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(8分)下图是我校实验室化学试剂浓硫酸标签上的部分内容。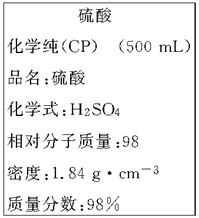
现需要480 mL 1 mol·L-1的稀硫酸。用该浓硫酸和蒸馏水配制,可供选用的仪器有:
①胶头滴管;②玻璃棒;③烧杯;④量筒。
请回答下列问题:
(1)配制稀硫酸时,还缺少的仪器有_________________(写仪器名称)。
(2)经计算,所需浓硫酸的体积约为________mL;若将该浓硫酸与等体积的水混合,所得溶液中溶质的质量分数____49%(填“>” 、“<” 或“=”)。
(3)对所配制的稀硫酸进行测定,发现其浓度大于1 mol·L-1,配制过程中下列各项操作可能引起该误差的原因是________。
①用量筒量取浓硫酸时,仰视刻度线
②容量瓶用蒸馏水洗涤后未经干燥
③用量筒量取浓硫酸后,用蒸馏水将量筒洗涤干净,洗涤液转移到烧杯中
④转移溶液时,不慎有少量溶液洒出
⑤定容时,俯视容量瓶刻度线
⑥定容后,把容量瓶倒置摇匀,正放后发现液面低于刻度线,再加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
用Na2CO3·10H2O晶体,配制0.2 mol·L-1的Na2CO3溶液480 mL。
(1)应称取Na2CO3·10H2O晶体的质量为 。
(2)根据下列操作对所配溶液的浓度产生的影响,完成下列要求:
①Na2CO3·10H2O晶体失去了部分结晶水
②碳酸钠晶体不纯,其中混有氯化钠
③称量碳酸钠晶体时所用砝码生锈
④容量瓶未经干燥使用
其中引起所配溶液浓度偏高的有 (填序号,下同),偏低的有 ,无影响的有 。
(3)某同学改用固体Na2CO3配制上述Na2CO3溶液的过程如图所示: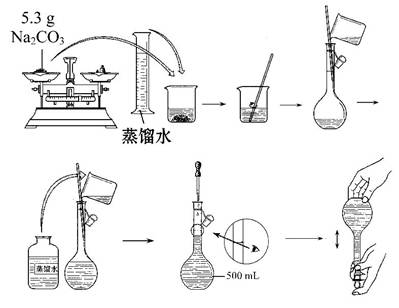
你认为该同学的错误步骤有 (填序号)。
| A.1处 | B.2处 | C.3处 | D.4处 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com