
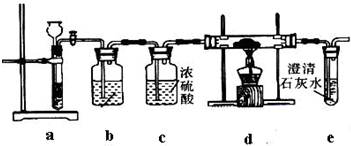
某实验小组用燃烧分析法测定某有机物中碳和氢等元素的含量,随后又对其进行了性质探究。将已称量的样品置于氧气流中,用氧化铜作催化剂,在高温条件下样品全部被氧化为水和二氧化碳,然后分别测定生成的水和二氧化碳。实验可能用到的装置如下图所示,其中A、D装置可以重复使用。

请回答下列问题:
(1)请按气体流向连接实验装置B→?????? ? →C→A→D→???????? (用装置编号填写)。
(2)B装置中制O2时所用的药品是???????????????????????????????????????????? 。实验中,开始对C装置加热之前,要通一段时间的氧气,目的是???????????????????????????????????? ;停止加热后,也要再通一段时间的氧气,目的是?????????????????????????????????? .。
(3)已知取2.3g的样品X进行上述实验,经测定A装置增重2.7g,D装置增重4.4g。试推算出X物质的实验式?????????????????????????? 。
(4)该小组同学进一步实验测得:2.3g的 X与过量金属钠反应可放出560mLH2(已换算成标准状况下),且已知X分子只含一个官能团。查阅资料后,学生们又进行了性质探究实验:实验一:X在一定条件下可催化氧化最终生成有机物Y;实验二:X与Y在浓硫酸加热条件下生成有机物Z。则:①写出实验二中反应的化学方程式?????????????????????????????????????? 。
② 除去Z中混有的Y所需的试剂和主要仪器是????????????? 、????????????? 。
(5)若已知室温下2.3g液态X在氧气中完全燃烧生成二氧化碳气体和液态水时可放出68.35kJ的热量,写出X在氧气中燃烧的热化学方程式????????????????????????????????????????? 。
(1)A;? D;(2)H2O2和MnO2 或Na2O2和 H2O;赶出装置中的二氧化碳和水蒸气等;将燃烧生成的二氧化碳和水蒸气彻底排出,并完全吸收;(3)C2H6O;
(4)① CH3COOH + C2H5OH CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
② 饱和Na2CO3溶液、分液漏斗
(5)C2H5OH(l)+3O2(g) =2CO2(g)+3H2O(l);△H=-1367 kJ/mol
【解析】
试题分析:(1)根据实验的目的、原理及装置的作用确定装置的连接次序;本实验为燃烧法确定有机物的组成。实验过程中,为保持测定结果的准确性,必须防止空气中二氧化碳和水蒸气的干扰。装置B为氧气的发生装置,制得的氧气中含有水蒸气,必须除去,应连接装有浓硫酸的洗气瓶,然后连接装置C,发生主体反应,再用装有浓硫酸的洗气瓶吸收水蒸气,用装有碱石灰的U形管吸收二氧化碳,最后再用装有碱石灰的U形管防止空气中二氧化碳和水蒸气的干扰,按气体流向连接实验装置B→A →C→A→D→D;(2)B装置为固液不加热制气体的发生装置,用该装置制O2时所用的药品是H2O2和MnO2 或Na2O2和 H2O;实验中,为保持测定结果的准确性,必须防止空气中二氧化碳和水蒸气的干扰,则开始对C装置加热之前,要通一段时间的氧气,目的是赶出装置中的二氧化碳和水蒸气等;停止加热后,也要再通一段时间的氧气,目的是将燃烧生成的二氧化碳和水蒸气彻底排出,并完全吸收;(3)根据题意知,A装置增重的2.7g为生成水的质量,物质的量为0.15 mol ,则有机物中氢原子的物质的量为0.3mol,氢元素质量为0.3g;D装置增重的4.4g为二氧化碳的质量,物质的量为0.1mol,则有机物中碳原子的物质的量为0.1mol,碳元素质量为1.2g;则有机物中一定含有氧元素。氧元素质量为:m(O)=2.3-1.2-0.3=0.8g,氧原子的物质的量为0.05mol,所以实验式为:C2H6O;(4)根据X的实验式及题给信息判断,X为乙醇,Y为乙酸,Z为乙酸乙酯。①实验二中的反应为乙酸和乙醇的酯化反应,化学方程式CH3COOH + C2H5OH CH3COOC2H5 + H2O;② 除去乙酸乙酯中混有的乙酸所需的试剂为饱和Na2CO3溶液,方法为分液,用到的主要仪器是分液漏斗;(5)根据题给信息写出乙醇燃烧的热化学方程式为C2H5OH(l)+3O2(g) =2CO2(g)+3H2O(l);△H=-1367 kJ/mol。
CH3COOC2H5 + H2O;② 除去乙酸乙酯中混有的乙酸所需的试剂为饱和Na2CO3溶液,方法为分液,用到的主要仪器是分液漏斗;(5)根据题给信息写出乙醇燃烧的热化学方程式为C2H5OH(l)+3O2(g) =2CO2(g)+3H2O(l);△H=-1367 kJ/mol。
考点:考查化学实验基本操作,有机物分子式和结构式的确定、乙醇的性质、热化学方程式的书写。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 测试时间段 | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
| 序号 | 二氧化硫的性质 | 主要操作和现象 | 化学方程式 |
| ① | 将二氧化硫通入装有品红溶液的试管中,品红由红色变为无色 | ||
| ② | 氧化性 | ||
| ③ | 将二氧化硫通入装有新制氯水的试管中,氯水由浅黄绿色变为无色 |
查看答案和解析>>
科目:高中化学 来源:化学选修有机化学基础综合卷 题型:实验题
( 16分 ) 某校化学课外兴趣小组的学生为了验证乙醇的分子结构,设计如下实验程序: 乙醇的组成元素的测定、分子式的测定、分子结构的测定。
( 1 ) 他们决定用燃烧乙醇分析产物来确定乙醇中含有C、H两种元素。简要说明他们的具体操作: ①证明含有氢元素的操作是 _________________ 。②证明含有碳元素的操作是 ____________________ 。
( 2 ) 要用燃烧分析产物证实乙醇中还含有氧元素时,需取得一些实验数据,这些数据应该是 __________________ 。
( 3 ) 为确定乙醇的分子式,除 ( 2 ) 中数据外,还需不需测定乙醇的相对分子质量?
( 4 ) 为测定乙醇分子结构,他们用了无水乙醇和金属钠反应收集生成氢气的方法,选用了如下图所示的仪器 ( 有的仪器配用双孔橡皮塞 ) 。
①装置的连接顺序是 ________ 接 _________ 接 _________ 接 _________ 接
__________ 接 ______________ 。
②由实验证明乙醇的分子结构是CH3CH2OH而不是CH3OCH3的理由是 _________________ 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年陕西省宝鸡市高三质检(一)理综化学试卷(解析版) 题型:实验题
某实验小组用燃烧分析法测定某有机物中碳和氢等元素的含量,随后又对其进行了性质探究。将已称量的样品置于氧气流中,用氧化铜作催化剂,在高温条件下样品全部被氧化为水和二氧化碳,然后分别测定生成的水和二氧化碳。实验可能用到的装置如下图所示,其中A装置可以重复使用。

请回答下列问题:
(1)请按气体流向连接实验装置? →? →? →d→? →? →? → g(用仪器接口编号填写)。
(2)B装置中制O2时所用的药品是??????? 。实验中,开始对C装置加热之前,要通一段时间的氧气,目的是?????? ;停止加热后,也要再通一段时间的氧气,目的是???????? 。
(3)已知取2.3g的样品X进行上述实验,经测定A装置增重2.7g,D装置增重4.4g。试推算出X物质的实验式??????? 。
 (4)该小组同学进一步实验测得:2.3g的 X与过量金属钠反应可放出560mLH2(已换算成标准状况下),且已知X分子只含一个官能团。查阅资料后,学生们又进行了性质探究实验:
(4)该小组同学进一步实验测得:2.3g的 X与过量金属钠反应可放出560mLH2(已换算成标准状况下),且已知X分子只含一个官能团。查阅资料后,学生们又进行了性质探究实验:
实验一:X在一定条件下可催化氧化最终生成有机物Y.
实验二:X与Y在浓硫酸加热条件下生成有机物Z.
则①写出实验二中反应的化学方程式??????????????????????????????????? 。
②除去Z中混有的Y所需的试剂和主要仪器是???????? 、??????????? 。
(5)若已知室温下2.3g液态X在氧气中完全燃烧生成二氧化碳气体和液态水时可放出68.35kJ的热量,写出X在氧气中燃烧的热化学方程式???????????????????????? 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com