
 取Na2CO3和NaHCO3的混合物8.22g,加热到质量不再发生变化,冷却后称其质量为6.36g.
取Na2CO3和NaHCO3的混合物8.22g,加热到质量不再发生变化,冷却后称其质量为6.36g.分析 (1)设NaHCO3的物质的量为x,利用差量法计算出混合物中含有碳酸氢钠的物质的量,再根据m=nM计算出碳酸氢钠的质量,然后结合总质量计算出原混合物中含有的碳酸钠的物质的量,最后根据钠离子守恒及c=$\frac{n}{V}$计算出所得溶液中钠离子的浓度;
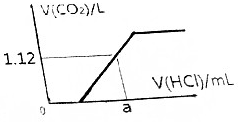
(2)根据图示可知,a点生成了1.12L二氧化碳气体,标准状况下1.12L二氧化碳的物质的量为:$\frac{1.12L}{22.4L/mol}$=0.05mol,根据计算可知(1)所配的溶液中含有0.06mol碳酸氢钠、0.03mol碳酸钠,向该溶液中加入盐酸过程中,碳酸钠先发生反应CO32-+H+=HCO3-,0.03mol碳酸钠转化成碳酸氢钠消耗0.03molHCl;然后发生反应HCO3-+H+=H2O+CO2↑,则生成0.05mo二氧化碳需要消耗0.05molHCl,再根据V=$\frac{n}{c}$计算出需要盐酸的体积.
解答 解:(1)设NaHCO3的物质的量为x,
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2+H2O△m
2mol 62g
x (8.22-6.36)g=1.86g
x=0.06mol,
则m(NaHCO3)=0.06 mol×84g/mol=5.04g,
原混合物中碳酸钠的物质的量为:$\frac{8.22g-5.04g}{106g/mol}$=0.03mol,
若取等质量的原混合物溶于水,配成80mL溶液,溶液中含有钠离子的物质的量为:n(Na+)=0.06mol×1+0.03mol×2=0.12mol,
所得溶液中钠离子浓度为:c(Na+)=$\frac{0.12mol}{0.08L}$=1.5mol/L,
故答案为:1.5;
(2)根据图示可知,a点生成了1.12L二氧化碳气体,标准状况下1.12L二氧化碳的物质的量为:$\frac{1.12L}{22.4L/mol}$=0.05mol,
根据计算可知(1)所配的溶液中含有0.06mol碳酸氢钠、0.03mol碳酸钠,向该溶液中加入盐酸过程中,碳酸钠先发生反应CO32-+H+=HCO3-,0.03mol碳酸钠转化成碳酸氢钠消耗0.03molHCl;然后发生反应HCO3-+H+=H2O+CO2↑,则生成0.05mo二氧化碳需要消耗0.05molHCl,
所以a点时总共消耗的HCl的物质的量为:0.03mol+0.05mol=0.08mol,
所以a点消耗盐酸的体积为:$\frac{0.08mol}{1mol/L}$=0.08L=80mL,
故答案为:80.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质及原理为解答关键,注意熟练掌握物质的量与物质的量浓度、摩尔质量、气体摩尔体积等之间的关系,试题培养了学生的分析、理解能力及化学计算能力.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:多选题
| A. | 常温下,14 g乙烯中含碳原子数为NA | |
| B. | 1 mol NH4+与1 mol OH-所含的电子数均为10NA | |
| C. | 常温常压下,22.4L CH4中含C-H键数目为4NA | |
| D. | 常温下,pH=13的NaOH溶液中含OH-数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
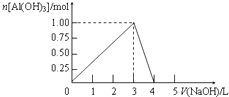 向体积为0.5L的AlCl3溶液中逐渐加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如图所示.下列结果正确的是( )
向体积为0.5L的AlCl3溶液中逐渐加入某浓度的NaOH溶液,得到的沉淀随NaOH溶液体积的变化如图所示.下列结果正确的是( )| A. | 反应过程中,沉淀最多时的质量为7.8g | |
| B. | AlCl3溶液的浓度为2.0 mol•L-1 | |
| C. | 得到39g沉淀时,消耗的NaOH溶液体积为1.5L或3.5L | |
| D. | 当V(NaOH)=4L时,得到的溶液中Na+、Cl-浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和钾的合金可用于快中子反应堆作热交换剂 | |
| B. | 可用超纯硅制造的单晶硅来制造计算机的芯片 | |
| C. | 实验室用二氧化锰和浓盐酸共热制取少量氯气 | |
| D. | 氢氧化钠溶液要盛放在磨口玻璃塞的试剂瓶里 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
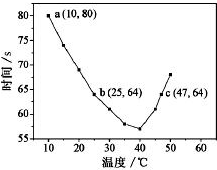 NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol•L-1NaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol•L-1NaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )| A. | 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 | |
| B. | 当NaHSO3完全消耗时的离子方程式为:6HSO3-+2IO3-=6SO42-+2I-+6H+ | |
| C. | 图中a点对应的NaHSO3反应速率为5.5×10-5mol•L-1•s-1 | |
| D. | 温度高于40℃时,淀粉不宜用作该实验的指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、S2-、Cl- | B. | Al3+、Mg2+、SO42-、Cl- | ||
| C. | K+、Na+、SiO32-、NO3- | D. | K+、Na+、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y单质不能与X的氢化物反应 | |
| B. | Y的氢化物是离子化合物 | |
| C. | 工业上冶炼Z通常用电解其熔融氯化物的方法 | |
| D. | W单质既能与酸反应,又能与碱反应,属于两性物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液不能盛装在玻璃塞的试剂瓶中 | |
| B. | 饱和食盐水使甲基橙显黄色 | |
| C. | FeCl3溶液加热蒸干得到Fe2O3 | |
| D. | 0.1mol/LCuCl2溶液中,c(Cu2+)<0.1mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com