
 工业上常用水蒸气通过炽热的焦炭制得水煤气(主要成分为CO和H2),其反应的化学方程式为C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1.请回答下列问题:
工业上常用水蒸气通过炽热的焦炭制得水煤气(主要成分为CO和H2),其反应的化学方程式为C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1.请回答下列问题:分析 (1)增大反应物浓度,正反应速率增大;
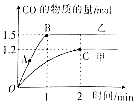
(2)①由图象可知甲容器中,0~2min内生成CO1.2mol,由方程式可知生成氢气1.2mol,进而可计算生成氢气的反应速率;
②升高温度,可增大反应速率,达到平衡时时间较少;
③根据温度的高低判断反应速率的大小.
解答 解:(1)当反应达到平衡后,再充入H2O(g),反应物浓度增大,则其正反应速率将增大,故答案为:增大;
(2)①由图象可知甲容器中,0~2min内生成CO1.2mol,由方程式可知生成氢气1.2mol,则v(H2)=$\frac{\frac{1.2mol}{2L}}{2min}$=0.3mol/(L•min),故答案为:0.3mol/(L•min);
②升高温度,可增大反应速率,达到平衡时时间较少,可知乙温度较高,故答案为:乙;
③由图象可知乙的温度较高,则B点的反应速率较大,故答案为:B.
点评 本题综合考查化学平衡问题,为高频考点,侧重考查学生的分析能力,主要把握图象中曲线的变化特点,把握外界条件对平衡移动的影响,难度不大.


科目:高中化学 来源: 题型:解答题
| 题号 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| 1 | 丙烷(丙烯) | ||
| 2 | CH3CH2OH (CH3COOH) | ||
| 3 | 苯(溴) | ||
| 4 | 乙烯(SO2、CO2) | ||
| 5 | CO2(SO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 适量的HCl | B. | 适量的NaCl | C. | 适量的氨水 | D. | 适量的NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二茂铁属于分子晶体 | |
| B. | 在二茂铁结构中,C5H5-与Fe2+之间形成的化学键类型是离子键 | |
| C. | 已知环戊二烯的结构式为: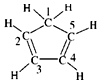 ,则其中仅有1个碳原子采取sp3杂化 ,则其中仅有1个碳原子采取sp3杂化 | |
| D. | C5H5-中一定含π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、X、Y元素的简单离子对水的电离平衡的影响是相同的 | |
| B. | 工业上获得X、Y单质的方法主要是电解其熔融的氯化物 | |
| C. | X、Y、Z的最高价氧化物对应的水化物两两之间能反应 | |
| D. | Y元素所形成的离子是其所在周期中半径最小的简单离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某化合物的熔融状态能导电,该化合物中一定有离子键 | |
| B. | 冰是分子晶体,受热分解的过程中,只需克服分子间的作用力 | |
| C. | 某纯净物在常温下为气体,则组成该物质的微粒一定含有共价键 | |
| D. | 化学变化中往往伴随着化学键的破坏与形成,物理变化中一定没有化学键的破坏或形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | Mn | Fe | |
| 电离能(kJ/mol) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下混合气体的体积为22.4L | |
| B. | 完全燃烧生成44g CO2 | |
| C. | 混合气体中氢原子个数为2NA | |
| D. | 完全燃烧转移的电子数为3mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com