
| A、0.1molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 |
| B、28 g乙烯分子中含有极性共价键的数目为6NA |
| C、100mL18mol/L浓硫酸与足量的铜反应,生成SO2的分子数小于0.9NA |
| D、足量的铁与0.1molC12充分反应,转移的电子数为0.3NA |
| m |
| M |
| m |
| M |
| 28g |
| 28g/mol |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、把100 mL 3 mol?L-1的H2SO4溶液跟100 mL H2O混合,硫酸的物质的量浓度变为1.5 mol?L-1 |
| B、把200 mL 3 mol?L-1的BaCl2溶液跟100 mL 3 mol?L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是 3 mol?L-1 |
| C、把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10% |
| D、把100 mL 20%的NaOH溶液跟100 mL H2O混合后,NaOH溶液的质量分数是10% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、I2 |
| B、KI |
| C、KIO3 |
| D、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol,在该反应中,当有3NA电子转移时,上述热化学反应方程式的焓变变为△H=46.2kJ/mol |
| B、1 L 0.1mol?L-1碳酸钠溶液的阴离子总数等于0.1 NA |
| C、室温下pH=13的NaOH溶液中含有的OH-0.1 NA |
| D、浓度分别为1 mol?L-1和 0.5mol?L-1的CH3COOH和CH3COONa 混合液共1L,含CH3COOH 和 CH3COO-共1.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4 的摩尔质量是 98 g |
| B、1 mol H2O的质量是 18 g/mol |
| C、Cl-的摩尔质量是 35.5 g/mol |
| D、1 mol H2O中含有2 mol H和1 mol O |
查看答案和解析>>
科目:高中化学 来源: 题型:
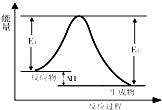 关于反应3A (g)+B (g)?2C (g) 发生过程中的能量变化如图,下列说法中不正确的是( )
关于反应3A (g)+B (g)?2C (g) 发生过程中的能量变化如图,下列说法中不正确的是( )| A、该反应为放热反应 |
| B、反应体系中加入催化剂,E1、E2减小,△H不变 |
| C、增大反应体系压强,化学平衡正向移动,气体B的浓度减少 |
| D、降低反应体系温度,反应速率减慢,A的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
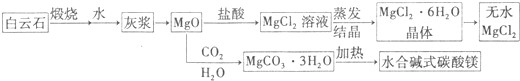
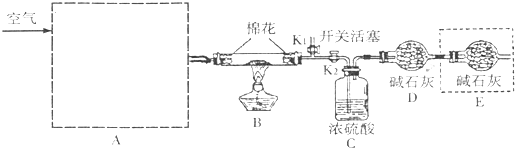
查看答案和解析>>
科目:高中化学 来源: 题型:
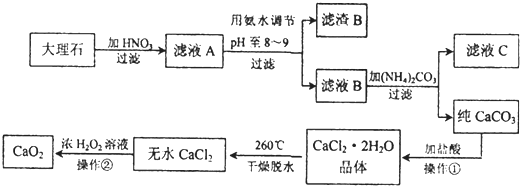
2- 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com