
| A. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ•mol-1 | B. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242 kJ•mol-1 | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-484kJ•mol-1 | D. | 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ•mol-1 |
分析 A.生成水的状态错误,应该为水蒸气;
B.2mol氢气燃烧生成水蒸气放出484kJ热量,所以热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol;
C.焓变与化学计量数成正比,1mol氢气完全反应放出的热量应该为242kJ;
D.该反应为放热反应,焓变应该为负值.
解答 解:A.生成水的状态应该为气态,正确的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol,故A错误;
B.2mol氢气燃烧生成水蒸气放出484kJ热量,则1mol氢气燃烧生成水蒸气放出242kJ热量,反应的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242kJ/mol,故B正确;
C.焓变的单位不合理,正确的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242kJ/mol,故C错误;
D.放热反应的焓变小于0,正确的热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol,故D错误;
故选B.
点评 本题考查了热化学方程式的书写,题目难度不大,明确热化学方程式的书写原则为解答关键,A为易错点,注意生成水的状态,试题侧重基础知识的考查,有利于培养学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:实验题
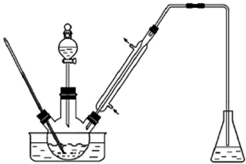 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置主要部分如图,相关物质的沸点见附表),附表相关物质的沸点(101kPa)
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置主要部分如图,相关物质的沸点见附表),附表相关物质的沸点(101kPa)| 物质 | 沸点/℃ | 物质 | 沸点/℃ |
| 溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
| 苯甲醛 | 179 | 间溴苯甲醛 | 229 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl固体(KNO3)溶解配成热饱和溶液、降温结晶 | |
| B. | CO(水蒸气)通过浓硫酸的洗气瓶 | |
| C. | CaO固体(CaCO3)高温煅烧 | |
| D. | KCl固体(MnO2)溶解、过滤、蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O(g)=H2(g)+$\frac{1}{2}$ O2(g)△H=+242 kJ/mol | B. | 2H2(g)+O2(g)=2H2O (l)△H=-484 kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$ O2(g)=H2O (g)△H=-242 kJ | D. | 2H2(g)+O2(g)=2H2O (g)△H=+484 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10min内,反应放出的热量为197kJ热量 | |
| B. | 10min内,X的平均反应速率为0.06mol•L-1•min-1 | |
| C. | 第10min时,Y的反应速率小于0.015mol•L-1•min-1(假如体系温度不变) | |
| D. | 第10min时,Z浓度为0.6mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室将硫酸铜溶液直接加热蒸干来制取CuSO4•5H2O | |
| B. | 用湿润的pH试纸来测溶液的pH | |
| C. | 不慎将浓碱溶液沾到皮肤上,可先立即用稀盐酸中和,后用大量水冲洗,再涂上2%~5%的硼酸溶液 | |
| D. | 用四氯化碳萃取溴水中的溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molOH-的质量是17g/mol | |
| B. | CO2的摩尔质量是44 | |
| C. | 标况下气体的摩尔体积是22.4L | |
| D. | 12gC-12中含的C原子数是阿伏伽德罗常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 碳酸钠溶液中加入澄清石灰水:Ca(OH)2+CO32-=CaCO3↓+2OH- | |
| C. | 氢氧化钠溶液中通入过量CO2:OH-+CO2=HCO3- | |
| D. | FeCl3溶液与Cu反应:Cu+Fe3+=Cu2++Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com