
 (1)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2$S{O}_{4}^{2-}$$?_{充电}^{放电}$2PbSO4+2H2O.请回答下列问题(不考虑氢、氧的氧化还原):
(1)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2$S{O}_{4}^{2-}$$?_{充电}^{放电}$2PbSO4+2H2O.请回答下列问题(不考虑氢、氧的氧化还原):分析 (1)电池总反应式为:Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O,写出电极反应为:负极电解反应:Pb-2e-+SO42-=PbSO4 ,正极电极反应:PbO2+2e-+4H++2SO42-=PbSO4+2H2O,依据电解反应和电池原理分析判断;
(2)①原电池是将化学能转化为电能的装置,原电池中负极上失电子发生氧化反应,正极上得电子发生还原反应,在得失电子相等的条件下,将正负电极上电极反应式相加即得电池反应式,根据电极反应判断溶液pH的变化;
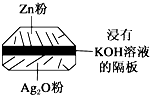
②负极电极反应式为Zn+2OH--2e-=ZnO+H2O、正极电极反应式为 Ag2O+H2O+2e-=2Ag+2OH-,所以电池反应式为Zn+Ag2O=2Ag+ZnO;
③该原电池中,Zn元素化合价由0价变为+2价、Ag元素化合价由+1价变为0价,所以Zn是负极失电子发生氧化反应,Ag2O是正极得电子发生还原反应;负极的电极反应式为:Zn+2OH--2e-=ZnO+H2O,则负极附近pH减小;正极电极反应式为 Ag2O+H2O+2e-=2Ag+2OH-,所以正极溶液的pH增大,电子转移相等的情况下负极消耗的氢氧根与正极产生的氢氧根离子的物质的量相等,所以溶液的pH值不变.
解答 解:(1)电池总反应式为:Pb+PbO2+4H++2SO2-4$?_{充电}^{放电}$2PbSO4+2H2O,写出电极反应为:负极电解反应:Pb-2e-+SO42-=PbSO4 ,正极电极反应:PbO2+2e-+4H++2SO42-=PbSO4+2H2O,放电时:正极的电极反应式是PbO2+2e-+4H++2SO42-=PbSO4+2H2O;电解液中H2SO4的浓度将减少;当外电路通过1mol电子时,依据电子守恒计算理论上负极板的质量增加0.5mol×303g/mol-0.5mol×207g/mol=48g;
故答案为:PbO2+2e-+4H++2SO42-=PbSO4+2H2O;小;48;:
(2)①A、负极电极反应式为Zn+2OH--2e-=ZnO+H2O、正极电极反应式为 Ag2O+H2O+2e-=2Ag+2OH-,所以电池反应式为Zn+Ag2O=2Ag+ZnO,所以氢氧化钾的量不变,故A错误;
B、由电极反应式可知,Zn的化合价由0价升高到+2价,被氧化,为原电池的负极,则正极为Ag2O,原电池中电子从负极流向正极,即从锌经导线流向Ag2O,故B错误;
C、正极电极反应为:Ag2O+H2O+2e-=2Ag+2OH-,负极电极反应:Zn+2OH-═Zn(OH)2+2e-,所以Zn是负极,Ag2O是正极,故C正确;
D、由电极反应式可知,Zn的化合价由0价升高到+2价,为原电池的负极,发生氧化反应,Ag2O是正极发生还原反应,故D错误;
故选C.
②负极电极反应式为Zn+2OH--2e-=ZnO+H2O、正极电极反应式为 Ag2O+H2O+2e-=2Ag+2OH-,所以电池反应式为Zn+Ag2O=2Ag+ZnO,
故答案为:Zn+Ag2O=2Ag+ZnO;
③该原电池中,Zn元素化合价由0价变为+2价、Ag元素化合价由+1价变为0价,所以Zn是负极失电子发生氧化反应,Ag2O是正极得电子发生还原反应;负极的电极反应式为:Zn+2OH--2e-=ZnO+H2O,则负极附近pH减小;正极电极反应式为 Ag2O+H2O+2e-=2Ag+2OH-,所以正极溶液的pH增大,电子转移相等的情况下负极消耗的氢氧根与正极产生的氢氧根离子的物质的量相等,所以溶液的pH值不变,
故答案为:减小;增大;不变.
点评 本题考查原电池知识,题目难度不大,注意根据电极反应判断原电池的正负极以及电池反应.


科目:高中化学 来源: 题型:解答题
| X | ||||
| Y | Z | W |
 .
.| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05mol | B. | 0.13mol | C. | 1.05mol | D. | 1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3mol | B. | 2.5mol | C. | 1mol | D. | 0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食品中大量添加苯甲酸钠等防腐剂,可有效延长其保质期 | |
| B. | “地沟油”可以制成生物柴油,提高资源的利用率 | |
| C. | 发展光伏发电等高效清洁能源,缓解能源危机 | |
| D. | 大力发展公共交通,提高汽油的质量,对减轻雾霾很有必要 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期/族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验内容 | 实验目的 |
| A | 向盛有10滴0.1 mol/LAgNO3溶液的试管中滴加0.1 mol/NaCl容液,至不再有沉淀生成,再向其中滴加0.lmol/LNa2S 溶液 | 证明在相同温度下,溶解度:AgCl>Ag2S |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO2溶液中存在水解平衡 |
| C | 分别向2mL甲苯、2mL苯、2niL正己烷中加入 3滴酸性高锰酸钾溶液,振荡,甲苯中酸性高锰酸钾溶液褪色,而苯、正己烷中酸性高锰酸钾溶液不褪色 | 证明与苯环相连的甲基易被氧化 |
| D | 取两只试管,分别加入4mL0.01mol/L KMn04酸性溶液,然后向一只试管中加入0.1mol/LH2C2O4溶液2mL,向另一只试管中加入0.1mol/LH2C2O4液4mL记录褪色时间 | 证明草酸浓度越大反应速率越快 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| H | He | ||||||
| Li | Be | B | C | N | O | F | Ne |
| Na | Mg | Al | Si | P | S | Cl | Ar |
 ,其最高价氧化物是酸性(填“酸性”或“碱性”)氧化物.
,其最高价氧化物是酸性(填“酸性”或“碱性”)氧化物. ,它属于共价(填“离子”或“共价”)化合物.NH3的还原性<(填“>”或“<”)PH3的还原性.
,它属于共价(填“离子”或“共价”)化合物.NH3的还原性<(填“>”或“<”)PH3的还原性.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铁作电极电解饱和氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 碱性镉镍可充电电池的正极反应:NiO(OH)-e-+H2O═Ni(OH)2+OH- | |
| C. | 肥皂水能使酚酞试液变红:C17H35COO-+H2O?C17H35COOH+OH- | |
| D. | 已知苯甲酸的酸性比碳酸强,向 溶液中通入过量CO2: 溶液中通入过量CO2: +2CO2+2H2O-→ +2CO2+2H2O-→ +2HCO3- +2HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com