
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A.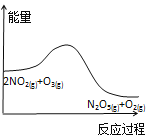 降低温度,平衡向正反应方向移动
降低温度,平衡向正反应方向移动
B. 0-3s内,反应速率v(NO2)=0.2mol·L-1
0-3s内,反应速率v(NO2)=0.2mol·L-1
C.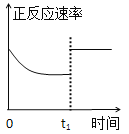 t1时仅加入催化剂,平衡正向移动
t1时仅加入催化剂,平衡正向移动
D.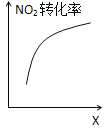 达到平衡时,仅改变X,则X为c(O2)
达到平衡时,仅改变X,则X为c(O2)
【答案】A
【解析】
A.由图可知,反应物总能量高于生成物总能量,正反应为放热反应,降低温度平衡向正反应方向移动,A正确;
B.由图可知,0~3s内,△c(NO2)=1mol·L-1-0.4mol·L-1=0.6mol·L-1,故v(NO2)= ![]() =0.2mol·L-1·s-1,单位错误,B错误;
=0.2mol·L-1·s-1,单位错误,B错误;
C.t1时刻,改变条件,反应速率加快,但正反应速率和逆反应速率仍相等,平衡不移动,该反应前后气体的物质的量减小,不是增大压强,只能是使用催化剂,但催化剂不影响平衡的移动,C错误;
D.达到平衡时,仅增大c(O2),平衡向逆反应方向移动,NO2转化率降低,由图可知,NO2的转化率随x增大而增大,x可以代表O3浓度、压强,D错误。
答案选A。


科目:高中化学 来源: 题型:
【题目】托卡朋(结构简式为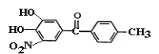 )是一种治疗帕金森氏病的药物。如图是其中的一种合成路线:
)是一种治疗帕金森氏病的药物。如图是其中的一种合成路线:
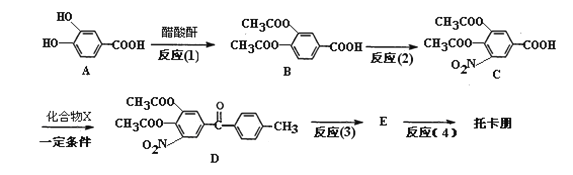
已知醋酸酐为两分子醋酸脱水形成的,结构简式为(CH3CO)2O。
(1)反应(1)的反应类型为____________,反应(2)的试剂和条件为________________。
(2)A分别与浓溴水、碳酸氢钠溶液、氢氧化钠溶液充分反应,所消耗的溴单质、碳酸氢钠、氢氧化钠的物质的量之比为________________。
(3)已知X为苯的相邻同系物,检验苯中含X的试剂为______________________。
(4)反应(1)的目的是__________________________________________________。
(5)D经过两步反应生成托卡朋,反应(3)的化学方程式为________________________。反应(4)中加入____________(试剂名称),得到托卡朋。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图可设计成多种用途的电化学装置。下列分析正确的是
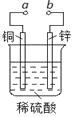
A.当a和b用导线连接时,溶液中的SO42-向铜片附近移动
B.将a与电源正极相连可以保护锌片,这叫牺牲阳极的阴极保护法
C.当a和b用导线连接时,铜片上发生的反应为:2H++2e-=H2↑
D.a和b用导线连接后,电路中通过0.02mol电子时,产生0.02mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物聚合物M:![]() 是锂电池正负极之间锂离子迁移的介质。由烃C4H8合成M的合成路线如下:
是锂电池正负极之间锂离子迁移的介质。由烃C4H8合成M的合成路线如下:
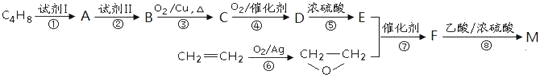
回答下列问题:
(1)C4H8的结构简式为_________________,试剂II是________________。
(2)检验B反应生成了C的方法是___________________________________________。
(3)D在一定条件下能发生缩聚反应生成高分子化合物,反应的化学方程式为___________;
(4)反应步骤③④⑤不可以为⑤③④的主要理由是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学用语的表示正确的是( )
A.N原子的最外层电子轨道表示式: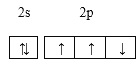
B.质子数为35、中子数为45的溴原子:![]() Br
Br
C.硫离子的结构示意图:![]()
D.间二甲苯的结构简式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“84”消毒液的成分是NaClO,某化学研究性学习小组在实验室制备NaClO并探究其性质。
(1)该学习小组用如图装置进行实验(部分夹持装置略去),反应一段时间后,取C瓶中的溶液进行实验,测得溶液的pH=12。
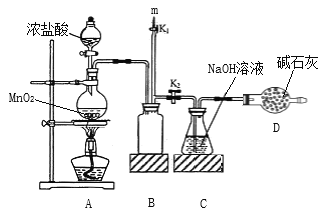
(查阅资料:饱和NaClO溶液pH为11)。
回答下列问题:
①装置A中发生反应的离子方程式为_______________________________。
②B装置的作用是__________________。
③C瓶溶液中的溶质是NaCl、______________(填化学式)。
(2)实验结束后,在m处最好连接盛________(填“NaOH 溶液”或“水”) 的注射器,然后打开K1关闭K2,最后再拆除装置。
(3)测定C瓶溶液中NaClO含量的实验步骤如下:
步骤1:将C瓶溶液加入硫酸酸化,加入过量KI溶液,塞紧瓶塞并在暗处充分反应后滴入5~6滴淀粉溶液。
步骤2:分两次各取步骤1的溶液20mL于锥形瓶中,用0.1000mol·L-1 Na2S2O3 标准溶液滴定,滴定终点时两次耗Na2S2O3 溶液体积的平均值为16.00mL。(已知:I2+2S2O32- =2I-+S4O62-)
①步骤1的C瓶中发生反应的离子方程式为:___________________________________。
②滴定终点的现象为______________________________________________________。
③塞紧瓶塞并在暗处反应的原因是_____________________________________。
④C瓶溶液中NaClO含量为____________g·L-1。
⑤若盛Na2S2O3 标准溶液的滴定管未用Na2S2O3 标准溶液润洗,则测得C瓶溶液中NaClO含量__________(填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个体积为2L的真空密闭容器中加入0.5molCaCO3,发生反应CaCO3(s)![]() CaO(s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如图表示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线。请按要求回答下列问题:
CaO(s)+CO2(g),测得二氧化碳的物质的量浓度随温度的变化关系如图表示,图中A表示CO2的平衡浓度与温度的关系曲线,B表示不同温度下反应经过相同时间时CO2的物质的量浓度的变化曲线。请按要求回答下列问题:
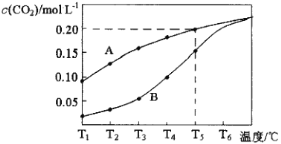
(1)该反应正反应为___(填“吸”或“放”)热反应,温度为T5℃时,该反应耗时40s达到平衡,则T5℃时,该反应的平衡常数数值为___。
(2)如果该反应的平衡常数K值变大,该反应___ (选填编号)。
a.一定向逆反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向正反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)请说明随温度的升高,曲线B向曲线A逼近的原因:___。
(4)在T5℃下,维持温度和容器体积不变,向上述平衡体系中再充入0.5molN2,则最后平衡时容器中的CaCO3的质量为___ g。
(5)已知苯酚和碳酸的电离平衡常数如图所示。请写出二氧化碳通入苯酚钠溶液的化学反应离子方程式___,请用电离平衡原理解释上述反应发生的原因以及确定生成物的依据___。
物质 | 电离平衡常数(25℃) |
C6H5OH | Ki=1.28×10-10 |
H2CO3 | Ki1=4.3×10-7 |
Ki2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组有机物中,无论以何种比例混合,只要二者的物质的量之和不变,完全燃烧时消耗的氧气及生成的水的物质的量也不变的是
A.C2H2和C6H6
B.C2H6和C2H5OH
C.C2H4和C2H6O
D.C6H6和C7H6O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按以下步骤可从![]() 合成
合成![]() (部分试剂盒反应条件已略去):
(部分试剂盒反应条件已略去):
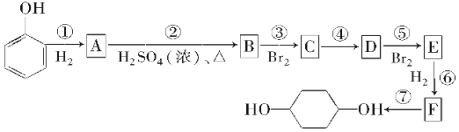
请回答下列问题:
(1)写出E的结构简式:___,B中有可能所有碳原子共面___(填是或否)。
(2)反应①~⑦中属于消去反应的是___,属于取代反应的是___。
(3)试写出A→B反应的化学方程式:___,C→D反应的化学方程式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com