
| A、O2 和 O3 |
| B、CO 和 CO2 |
| C、12C 和 13C |
| D、CH4 和 C2H6 |


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:
| A、5 mol?L-1?s-1 |
| B、6 mol?L-1?s-1 |
| C、2 mol?L-1?s-1 |
| D、3 mol?L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸铝溶液中加入过量烧碱:Al3++3OH-=Al(OH)3↓ |
| B、碳酸钠溶液中加入醋酸:CO32-+2H+=CO2↑+H2O |
| C、碳酸氢钠溶液中加入氢氧化钠:HCO3-+OH-=CO32-+H2O |
| D、常温时,浓硝酸中加入铁片:Fe+6H++3NO3-=Fe3++3NO2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单质都是由同种元素组成的,只含一种元素的物质一定是纯净物 |
| B、金属铝排在金属活动性顺序表中氢元素的前面,铝与酸反应一定放出氢气 |
| C、中和反应都有盐和水生成,有盐和水生成的反应都属于中和反应 |
| D、氧化物中都含有氧元素,含氧元素的化合物不一定是氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ①足量稀硫酸 |
| ②过滤 |
| ③通入足量Cl2 |
| ④加热煮沸 |
| ⑤稀释至250mL |
| ⑥用0.4000mol?L-1 |
| 的KI溶液滴定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
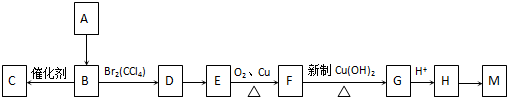
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com