
��6�֣���֪A��B��C��D��E��Ϊ�������ʣ���һ���������ת����ϵ����ͼ��ʾ����Ӧ�����Ͳ��ֲ�����ʡ�ԣ���

��ش�
��1����AΪ��������Fe��B��CΪ�ǽ������ʣ��ҳ�����B��C��Ϊ��ɫ���壬DΪ��ɫ���壬��B�ķ���ʽΪ_________��A��E��һ�������·�Ӧ����D�Ļ�ѧ����ʽΪ ��
��2����AΪ�ǽ������ʣ�BΪ�������ʣ�CΪ�����ᣬ��C������к�����A��ͬ��Ԫ�ء���C�ķ���ʽΪ___________��A��E��һ�������·�Ӧ����D�����ӷ���ʽΪ ��
��3����A��C�ֱ�Ϊ����ǿ��ͳ���ǿ�BΪ�����������B�ķ���ʽΪ_________��A��E��һ�������·�Ӧ����D�����ӷ���ʽΪ ��
��1��O2�� 3Fe��4H2O(g) Fe3O4��4H2 ��2��HCl�� 2Fe2+ + Cl2 = 2Fe3+ + 2Cl��
Fe3O4��4H2 ��2��HCl�� 2Fe2+ + Cl2 = 2Fe3+ + 2Cl��
��3��Al2O3�� AlO2����4H����Al3����2H2O
��������
�����������1����AΪ��������Fe��B��CΪ�ǽ������ʣ��ҳ�����B��C��Ϊ��ɫ���壬DΪ��ɫ���壬������ת����ϵͼ֪��BΪ������CΪ������DΪ������������EΪˮ����B�ķ���ʽΪO2������ˮ��һ�������·�Ӧ���������������Ļ�ѧ����ʽΪ3Fe��4H2O(g) Fe3O4��4H2 ����2����AΪ�ǽ������ʣ�BΪ�������ʣ�CΪ�����ᣬ��C������к�����A��ͬ��Ԫ�أ�������ת����ϵͼ֪��AΪ������BΪ����CΪ���ᣬDΪ�Ȼ�����EΪ�Ȼ���������C�ķ���ʽΪHCl ���������Ȼ�������һ�������·�Ӧ�����Ȼ��������ӷ���ʽΪ2Fe2+ + Cl2 = 2Fe3+ + 2Cl������3����A��C�ֱ�Ϊ����ǿ��ͳ���ǿ�BΪ�����������BΪ����������������������ʽΪAl2O3��ǿ���ƫ��������һ�������·�Ӧ�������ε����ӷ���ʽΪAlO2����4H����Al3����2H2O��
Fe3O4��4H2 ����2����AΪ�ǽ������ʣ�BΪ�������ʣ�CΪ�����ᣬ��C������к�����A��ͬ��Ԫ�أ�������ת����ϵͼ֪��AΪ������BΪ����CΪ���ᣬDΪ�Ȼ�����EΪ�Ȼ���������C�ķ���ʽΪHCl ���������Ȼ�������һ�������·�Ӧ�����Ȼ��������ӷ���ʽΪ2Fe2+ + Cl2 = 2Fe3+ + 2Cl������3����A��C�ֱ�Ϊ����ǿ��ͳ���ǿ�BΪ�����������BΪ����������������������ʽΪAl2O3��ǿ���ƫ��������һ�������·�Ӧ�������ε����ӷ���ʽΪAlO2����4H����Al3����2H2O��
���㣺����Ԫ�ػ�������ƶϡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ��У�����ڶ����������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����������ͨ������Ǩ�ƴ��ݵ�ɡ���RbAg4I5���壬����Ǩ�Ƶ�����ȫ��Ag+������RbAg4I5���壬�����Ƴɵ绯ѧ��������������ͼ��һ�ֲⶨO2���������崫����ʾ��ͼ����������O2���������ķ���ϩ��Ĥ���ɵ�ص綯�Ʊ仯���Ե�֪O2�ĺ����������崫�������������У����б仯�϶�û�з������ǣ� ��
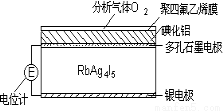
A��Ag��e-=Ag+ B��I2+2Ag++2e-=2AgI
C��I2+2Rb++2e-=2RbI D��4AlI3+3O2=2Al2O3+6I2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�˴��и���ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�㻨ʯ����Ϊ����ʯ��è�������ҹ�����ѧ���״η��֣�����ǰ20��Ԫ���е�6����ɣ��仯ѧʽΪX3Y2��ZWR4��3T2������X��Y��ZΪ����Ԫ�أ�Z��������������������ȣ�X��Zλ��ͬ�壬Y��Z��R��Tλ��ͬ���ڣ�R�����������Ǵ�����3����T�����ۣ�X��Rԭ������֮����W��2��������˵��������ǣ��� ��
A��ԭ�Ӱ뾶��Y>Z>R>T
B����̬�⻯����ȶ��ԣ�W<R<T
C������������Ӧ��ˮ������ԣ�X>Z
D�� XR2��WR2����������R�Ļ��ϼ���ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�ϲ��и߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����һ�ೣ�����ʣ��������ʿ�ֱ���γ��ε���
�ٽ��� �ڼ��������� �ۼ� �ܷǽ��� ������������ ����
A��ֻ�Т٢ڢ� B��ֻ�Тܢݢ�
C��ֻ�Т٢ڢۢݢ� D��ȫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�ϲ��и߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���й���û�з�����ѧ��Ӧ����
A���ú��轺�����۵���С����ʳƷһ���ܷ��װ
B�����ȼ�ˮ��������ϲ���������
C���ý��ݹ����������Һ�Ĺ���������ˮ��
D���û���̿ȥ�������е���ζ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�ϲ��и�һ�����ֿƲ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��һ�������£���ӦN2+3H2 2NH3����2L�ܱ������н��У�5min�ڰ�������������1.7g����Ӧ����Ϊ��
2NH3����2L�ܱ������н��У�5min�ڰ�������������1.7g����Ӧ����Ϊ��
A. v��NH3��=0.1 mol����L��min�� B. v��N2��=0.02 mol����L��min��
C. v��H2��=0.015 mol����L��min��D. v��NH3��=0.17 mol����L��min��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�ϲ��и�һ�����ֿƲ��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����й��������ʵ�˵���������
A�����ȶ��ԣ�HCl> HI B��ԭ�Ӱ뾶��Na> Mg
C���������������S2-> Cl- D�����ԣ�H2SO3>H2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ�߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A���� 100g10%����������������õ� 50 g��Һ����Ũ��Ϊ20%
B����3mol/L��������������ˮ��ϣ�������Һ��Ũ�ȴ���1.5 mol/L
C����200mL3mol/L��BaCl2��Һ��100mL3mol/L��KCl��Һ��Ϻ���Һ�е�c(Cl��)��Ȼ��3 mol/L
D����֪ij�¶���KNO3���ܽ���� 31.6 g/ 100 gˮ���ڸ��¶��½� 20 g��KNO3���� 50 g��ˮ�У�������Һ������������28.6%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ��һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ij�¶��£���2L������3�����ʼ���з�Ӧ�� X��Y��Z�����ʵ�����ʱ��ı仯������ͼ�����������������
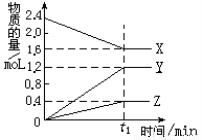
A���÷�Ӧ�Ļ�ѧ����ʽ��2X 3Y+Z
3Y+Z
B����t1minʱ���÷�Ӧ�ﵽ��ƽ��״̬
C��t1minʱ��X��Y��Z�ķ�Ӧ�������
D�����÷�Ӧ�Ѵﵽƽ��״̬ʱ��ÿ����1molZ��ͬʱ����2molX
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com