
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 1mol金属钠与氧气完全反应,转移的电子数一定为NA
B. 25℃时,pH=1盐酸溶液中含有H+的数目约为0.1NA
C. 任意条件下,1mol苯中含C-C键的数目一定为3NA
D. 密闭容器中充入1molNO2,气体分子数一定是NA
科目:高中化学 来源: 题型:
【题目】某同学称取一定质量的MgCl2固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如下图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如下图乙所示。

请回答下列问题:
(1)溶解MgCl2固体所用的玻璃仪器有______(填字母)。
a.天平 b.烧杯
c.漏斗 d.玻璃棒
(2)OA段反应的离子方程式为______________________________________。
(3)AB段反应的离子方程式为______________________________________。
(4)在B点对应的溶液中滴加AgNO3溶液,观察到的现象是________,反应的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的串联装置中,发现灯泡不亮,但若向其中一个烧杯加水,则灯泡会亮起来:
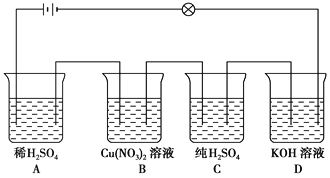
则:
(1)加水的烧杯为________。
(2)写出B、D烧杯中电解质的电离方程式:
B.___________________________________________________________________;
D.__________________________________________________________________。
(3)若在A烧杯中加入少量Ba(OH)2溶液后,溶液的导电性________,继续滴加Ba(OH)2溶液,可观察到灯泡的亮度________至________后又逐渐________。写出发生反应的离子方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图用铜锌原电池(电解质溶液为稀硫酸)在铁棒上电镀铜,下列叙述正确的是( )
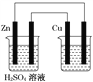
A. 铜在原电池中作负极,在电镀池中作阳极
B. 原电池溶液增加的质量比电镀池阴极增加的质量大
C. 锌棒每减少0.65 g,导线上转移的电子就为0.02 mol
D. 电镀池中的电解质溶液可用ZnSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置进行实验,甲乙两池均为1 mol·L–1的AgNO3溶液,A、B均为Ag电极。实验开始先闭合K1,断开K2。一段时间后,断开K1,闭合K2,形成浓差电池,灵敏电流计指针发生偏转(提示:Ag+ 浓度越大,氧化性越强)。下列说法不正确的是( )

A. 闭合K1,断开K2后,A电极增重
B. 闭合K1,断开K2后,乙池溶液中Ag+浓度增大
C. 断开K1,闭合K2后,NO3–向A电极移动
D. 断开K1,闭合K2后,B电极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)把铜片和铁片放在盛有稀食盐水和酚酞混合液的U形管中,如图所示,最终可在A极观察到酚酞变红。填空完成问题:
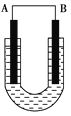
①A是原电池的_______极,代表金属____(填“铜”或“铁”);
②电极方程式分别为正极:______________________,原电池反应为_____________________________________。
(2)请从图中选出必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25 mL),并检验氯气的氧化性。
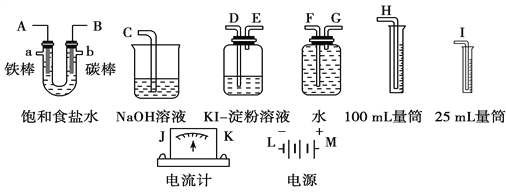
①A极发生的电极反应式是________________,B极发生的电极反应式是_______________。
②设计上述气体实验装置时,各接口的正确连接顺序为_________________________________________________________。
③实验中,在盛有KI淀粉溶液的容器中发生反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁性纳米四氧化三铁在催化剂、DNA检测、疾病的诊断和治疗等领域应用广泛,其制备方法有多种,“共沉淀法”制备纳米Fe3O4的流程如下:

(1)Ⅱ中的反应温度需控制在50℃~60℃之间,实验室控制该温度的最佳方法是___________。
(2)Ⅱ中生成Fe3O4的离子方程式是_____________________________________。
(3)操作Ⅲ包含的方法有_______________。
(4)检验纳米Fe3O4中含有+2价铁元素的方法是_________________________________。
(5)某同学依据上述“共沉淀法”的思路在实验室模拟制备纳米Fe3O4:
① 制备时该同学选择n(Fe3+)∶n(Fe2+)小于2∶1,原因是_______________________。
②经过多次实验发现,当混合溶液中n(Fe3+)∶n(Fe2+)=1∶1时,容易得到理想的纳米Fe3O4。该实验室无FeCl2溶液,现用5mLFeCl3溶液制备Fe3O4,配制n(Fe3+)∶n(Fe2+)=1∶1混合溶液的方法是_____________________(其它试剂和仪器自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)许多金属元素有焰色反应,金属存在焰色反应的原因是___________________________。
(2)基态铝原子中,有______种电子运动状态,其中p轨道的电子云轮廓图的形状为_______。
(3)我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。
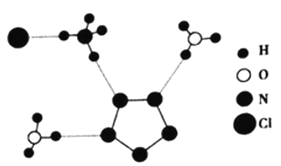
①图中R中阳离子是______(填写化学式),相对分子质量较大的阳离子中心原子的杂化类型是____。
②图中R中阴离子N5-中的σ键总数为___________个。分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则N5- 中的大π键应表示为___________。
),则N5- 中的大π键应表示为___________。
(4)氮与铝之间形成化合物X,具有耐高温抗冲击等性能。X的晶体结构如图所示。
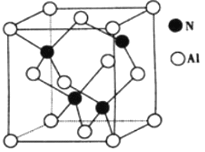
①已知氮化硼与X晶体类型相同,推测氮化硼的熔点比X的熔点___________(填“高”、“低“ ) ,可能的原因是_________________________________________。
②若X的密度为ρg·cm-3,则晶体中最近的两个Al原子的距离为___________cm。(阿伏加德罗常数的值用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度晶硅是典型的无机非金属材料,又称“半导体”材料.它的发现和使用曾引起计算机的一场“革命”。它可以按下列方法制备:

下列说法不正确的是
A. 步骤①的化学方程式为:SiO2+C![]() Si+CO2↑
Si+CO2↑
B. 步骤①中每生成1mol Si,转移4mol电子
C. 高纯硅是制造太阳能电池的常用材料,二氧化硅是制造光导纤维的基本原料
D. SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点67.6℃),通过蒸馏(或分馏)可提纯SiHCl3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com