
物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液的体积比为
3∶2∶1时,三种溶液中Cl物质的量浓度之比为 ( )
A. 1∶1∶1 B.1∶2∶3 C.3∶2∶1 D. 3∶4∶3
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
已知H-H键键能(断裂时吸收或生成时释放的能量)为436 kJ·mol-1,H-N键键能为391 kJ·mol-1,根据热化学方程式:
N2(g) +3H2(g) =2NH3(g) ΔH=-92.4 kJ·mol-1。则N≡N键的键能是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲是一种盐,由A、B、C、D、E五种元素组成,其中四种是短周期元素。甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子。A元素原子核内质子数比E的少1,D、E处于同主族。
用甲进行如下实验:
①取少量甲的晶体溶于蒸馏水配成溶液;
②取少量甲溶液于试管中滴入KSCN溶液,无现象,再滴入氯水,溶液呈红色;
③取少量甲溶液于试管中加入适量NaOH溶液,加热;
④取少量甲溶液于试管中,向其中加入稀盐酸,再加入BaCl2溶液,出现白色沉淀。
回答下列问题:
(1)C的元素符号是 ,D在周期表中的位置 。
(2)用离子方程式表示实验②中现象的原因: 。
(3)实验③中出现的现象是 。
(4)甲中阳离子与阴离子物质的量之比为3:2,则甲的化学式为 。
(5)某同学以氨气和二氧化碳为原料制备碳酸氢铵。合理的方案是
A.先将二氧化碳通入水中,充分溶解后,再通入氨气。
B.先将氨气通入水中,充分溶解后,再通入二氧化碳。
检验产物中有NH4+的方法为
查看答案和解析>>
科目:高中化学 来源: 题型:
设阿伏加德罗常数为NA ,则下列说法正确的是( )
A、常温常压下,11.2 L甲烷中含有的氢原子数为2NA,
B、标准状况下,0.3 mol 二氧化硫中含有氧原子数为0.3NA,
C、4g金属钙变成钙离子时,失去电子数目为0.1NA
D、常温下,1 L 0.1mol·L-1 MgCl2溶液中含有Mg2+ 数为0.1NA,
查看答案和解析>>
科目:高中化学 来源: 题型:
在无色透明溶液中,能大量共存的离子组是( )
A、 K+ Cu2+ Na+ SO42- B、 Mg2+ Cl - OH- SO42-
C、 K+ H+ NO3- CO32- D、 Na+ Cl - NO3- CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
选择下列试验方法分离物质,将分离方法的序号填在横线上。
A 萃取分液法 B 加热分解 C 分液法 D 蒸馏法 E 过滤法
(1) 分离饱和食盐水与沙子的混合物
(2) 分离水和汽油的混合物
(3) 从碘的水溶液里提取碘
(4) 分离四氯化碳(沸点76.75℃)和甲苯(沸点110.6℃)的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.16 8O2和18 8O2互为同位素,性质相似
B.铁放入稀硫酸中,再加入硝酸钠可以加快放出氢气的速率
C.明矾和漂白粉常用于自来水净化和杀菌消毒,两者作用原理相同
D.C(石墨,s)=C(金刚石,s) △H>0,所以石墨比金刚石稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上生产MnO2和Zn的主要反应有
① MnO2 + ZnS + 2H2SO4 = MnSO4 + ZnSO4 + S + 2H2O
② MnSO4 + ZnSO4 + 2H2O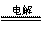 MnO2 + Zn + 2H2SO4
MnO2 + Zn + 2H2SO4
下列说法不正确的是
A.①中MnO2和H2SO4都是氧化剂
B.①中析出16 g S时转移1 mol 电子
C.②中MnSO4发生氧化反应
D.硫酸在该生产中可循环使用
查看答案和解析>>
科目:高中化学 来源: 题型:
250℃和1.01×105 Pa时, 2N2O5(g) = 4NO2(g) + O2(g) △H= +56.76 kJ/mol,该反应能自发进行的原因是
A.是吸热反应 B.是放热反应
C.是熵减少的反应 D.熵增大效应大于焓效应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com